如图是氯化钠和硫酸钠的溶解度曲线,看图后回答问题:

(1)的溶解度收温度影响变化不大。
(2)温度不变时,若将氯化钠的不饱和溶液变为饱和溶液可采取的方法是。(填一种即可)
(3)40℃时,将30
硫酸钠固体加入到50
水中充分溶解,所得溶液的质量是。
(4)用降温结晶的方法提纯含少量杂质氯化钠的硫酸钠,最佳的温度范围是℃以下,理由是。
如图1是a、b、c三种物质的溶解度曲线,回答下列问题:

(1)P点的含义是。
(2)
时,将50g a物质放入50g水中充分溶解得到溶液的质量为g。
(3)将
时,a、b、c三种物质的饱和溶液降温至
,所得溶液中溶质的质量分数由大到小的顺序是
(4)
时,将盛有c的饱和溶液的小试管放入盛水的烧杯中(如图2),向水中加入一定量的氢氧化钠固体后,试管中的溶液变浑浊,原因是 。
实验室配制50g质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足量的硝酸钾固体和水,请选用上述药品设计三种配制方案,并填入下表:
| |
配制方案(只要说明配制所需的各种药品及用量即可) |
| 方案一 |
|
| 方案二 |
|
| 方案三 |
|
如图是
,
,
三种固体物质的溶解度曲线,请回答下列问题:

(1)
点的含义是;
(2)若
点混有少量
时,可采用的方法提纯
;
(3)
℃时,能不能配制溶质的质量分数为40%的
溶液?(填"能"或"不能");
(4)
℃时,将
,
,
三种固体物质各30
加入到100
水中,充分溶解,形成不饱和溶液的是;
(5)将
℃时
,
,
三种固体物质的饱和溶液升温到
℃,其溶质的质量分数由大到小的顺序是。
20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示。

请回答下列问题:
(1)图1中一定是饱和溶液的是溶液(填"甲"或"乙");图2中乙溶液一定是溶液(填"饱和"或"不饱和")。
(2)图3中表示乙的溶解度曲线的是(填"M"或"N");图2中乙溶液降温至30℃析出晶体(填"会"或"不会")。
(3)50℃时甲的饱和溶液中溶质质量分数为(计算结果精确到0.1%)。
如图是甲、乙两种固体物质的溶解度曲线.据图回答:

(1)P点的含义 。
(2)要使接近饱和的甲溶液变成饱和溶液,可采用的方法有 (写出一种),当甲中含有少量乙时,可采用 的方法提纯甲.
(3)30℃时,将40g甲物质放入盛有50g水的烧杯中,所得溶液溶质的质量分数为 .若烧杯内物质升温到50℃(不考虑蒸发 ),溶液中变化的是 (选填序号).
a.溶质的质量 b.溶液的质量 c.溶质的质量分数
(4)从图中还可获得的信息是 、 (答出二条).
甲、乙两种固体物质的溶解度曲线如图所示.

(1)
时甲物质的溶解度是
;乙物质的溶解度随着温度的升高而(填"增大"或"减小");
(2)
时甲物质的饱和溶液中溶质的质量分数为;将
时甲、乙两种物质的饱和溶液分别降温至
,溶液中溶质质量分数大小关系是:甲(填"<"、"="或">")乙.
如图是甲、乙、丙三种固体物质的溶解度曲线。

① P点的含义 。
② 要使接近饱和的甲溶液变成饱和溶液,可采用的方法有 (写出一种)。当甲溶液中含有少量乙时,可采用 的方法提纯甲。
③ t2℃时,将30 g甲物质放入50 g水的烧杯中,所得溶液溶质的质量分数为 (精确到0.1)。若烧杯内物质升温到t3℃(不考虑水蒸发),溶液中变化的是 。
Ⅰ.溶质的质量 Ⅱ.溶剂的质量 Ⅲ.溶质的质量分数
④ t2℃时,在含有50 g水的甲和乙的饱和溶液中,分别加入m g甲和m g乙,升温至t3℃,甲完全溶解,乙仍有剩余,则m的质量范围是 。
请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为 g,所需蒸馏水的体积为 mL(水的密度约为1g/mL)。
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应 (填标号)。
A.先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡。
B.先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡。
【探究一】在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 (填“有”或“没有”)影响,理由是 .
(3)量取:准确量取所需蒸馏水要用到的仪器是 (选填图中的标号)。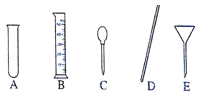
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解。
【探究二】:20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为: g/mL.
| 温度℃ 质量分数% |
20 |
40 |
60 |
| 4 |
1.023 |
1.016 |
1.007 |
| 10 |
1.063 |
1.054 |
1.044 |
(9分) 下图是小华配制100g溶质质量分数为7.5%的NaCl溶液的实验操作示意图:

(1)上图中的玻璃仪器分别是广口瓶、量筒、 和玻璃棒,其中玻璃棒在此操作中的作用是 。
(2)指出图②中的一处错误操作 。
(3)通过计算确定需要水的质量是 g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。
(4)下列错误操作可能导致溶液溶质的质量分数小于7.5%的是_____(填序号)
A ②操作中食盐与砝码放置颠倒;
B ①操作中有固体洒落;
C ⑤操作中有水溅出;
D 读取量筒内液体体积于视线过低;
E 装瓶存放操作中溶液洒落。
(5)该同学在称量氯化钠药品前天平的指针偏左,则所配制的溶液的质量分数 (填“偏大”“偏小”“不受影响”)
水是生命的源泉,下列变化与水相关。请回答:
①二氧化碳溶于水发生反应的化学方程式是 (1) 。
②自来水厂净水过程中常用到活性炭,其作用是 (2) 。
③铁丝在氧气中燃烧时,集气瓶内放少量水的目的是 (3) 。
④除去粗盐中泥沙等难溶性杂质的实验步骤:

I. 操作a的名称是 (4) ;
II. 三个步骤都用到的玻璃仪器是 (5) 。
⑤甲和乙两种固体物质(不含结晶水)的溶解度曲线如下图所示,回答下列问题:
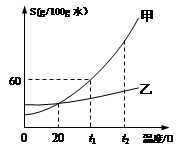
I.在 (6) ℃时,甲和乙两种物质的溶解度相等。
II.t1℃时,将50g固体甲加到50g水中,充分搅拌后所得溶液的质量为 (7) g。
III.甲的饱和溶液中含有少量的乙,由该液体得到固体甲采用的方法是 (8) 。
IV.若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是 (9) 。
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量变大
⑥下图是对20℃一定质量的丙溶液进行恒温蒸发结晶的实验过程,请回答:
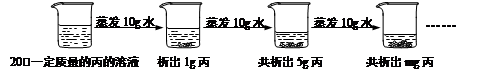
I.蒸发前原溶液是 (10) (填“饱和”或“不饱和”)溶液;m的数值是 (11) 。
II.依据上述实验,你认为丙的溶解度随温度变化的趋势是 (12) (填字母)。
A.随温度升高而增大 B.随温度升高而减小 C.无法判断
、
、
三种固体物质在水中的溶解度曲线如图所示,请回答:

(1)℃时,
、
两种物质在100
水中达到饱和状态时溶解的质量相等;
(2)若
中混有少量的
,最好采用的方法提纯
;
(3)现有接近饱和的
物质溶液,使其变成饱和溶液的方法有:①加入
物质;②恒温蒸发溶剂;③;
(4)
℃时将20
物质放入50
水中,充分搅拌,所得溶液中溶质的质量分数是;
(5)将
℃时等质量的
、
、
三种物质的饱和溶液降温至
℃时,所得溶液的质量由大到小的顺序是。
甲、乙、丙三种物质的溶解度曲线如图所示.据图回答:

30℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为 ;要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是 ;50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是 ,所得溶液中溶质质量分数最小的是 [50℃时,30g乙物质加入到50g水中不断搅拌,所得溶液的质量是 .
如图是甲、乙、丙(均不含结晶水)三种物质的溶解度曲线,请据图回答下列问题.

(1)在40℃时,甲、乙、丙三种物质的溶解度由大到小的关系是 (物质间用“>”连接);
(2)将30℃的三种物质的饱和溶液冷却到20℃后,所得溶液中溶质的质量分数由小到大的关系是:
(物质间用“<”连接);
(3)现有一定质量的B溶液,将该溶液在50℃下恒温蒸发10克水后析出了2克B晶体,再恒温蒸发5克水后,又析出了2克B晶体,则B物质在50℃时的溶解度是: .
如图所示,
、
、
为三种物质的溶解度曲线,请根据图示信息回答下列问题。

(1)
℃时,
、
、
三种物质中溶解度最小的是。
(2)
℃时,将20
物质投入100
水中,充分溶解,温度不变,所得溶液为溶液(填"饱和"或"不饱和")。
(3)下列说法正确的是。
| A. |
℃时,将 和 的混合溶液(两者均已达到饱和),降温到 ℃,析出的晶体含有 和 |
B. | 从混有少量 的 物质中提取较纯净的 ,可通过冷却它们的热饱和溶液实现 |
| C. |
℃时,将 、 、 的饱和溶液分别降温到 ℃,所得溶液中溶质质量分数的大小关系是 > > |
D. | ℃时,欲用 的饱和溶液配制10%的 溶液,只需要烧杯、量筒、胶头滴管三种玻璃仪器 |
(4)如图所示,向放有镁条的试管中滴加稀盐酸后,锥形瓶中
的饱和溶液变浑浊。请解释原因。
