上海市闵行区九年级上学期质量调研考试化学试卷
常温下测得一些食物的近似pH,显碱性的是
| A.苹果汁:3.1 | B.番茄汁:4.2 | C.牛奶:6.5 | D.玉米粥:7.5 |
用途仅由物理性质决定的是
| A.石墨作铅笔芯 | B.生石灰作干燥剂 | C.N2作保护气 | D.CO2作灭火剂 |
化学用语与表示意义相符合的是
| A.Cl2:2个氯原子 | B.Zn:1个锌分子 |
| C.2Fe:2个铁原子 | D.3S:3个硫元素 |
物质名称和化学式书写都正确的是
| A.硫酸钠:NaSO4 | B.氢氧化亚铁:Fe(OH)2 |
| C.贡:Hg | D.硝酸钾:KnO3 |
解释“火上浇油”的说法合理的是
| A.增加易燃物,使燃烧更旺 | B.增大氧气浓度,使燃烧更旺 |
| C.提高可燃物的着火点,使燃烧更旺 | D.提高物质的接触面积,使燃烧更旺 |
化学方程式书写正确的是
A.4Fe+3O2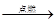 2Fe2O3 2Fe2O3 |
B.CaCO3→CaO+CO2↑ |
C.2H2+O2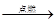 2H2O 2H2O |
D.CO+O2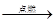 CO2 CO2 |
我国科学家屠呦呦因发现治疗疟疾的“青蒿素(C15H22O5)”而获得诺贝尔奖。说法正确的是
| A.青蒿素分子的式量为282g/mol | B.青蒿素中氢元素含量最高 |
| C.青蒿素由42个原子构成 | D.氢氧元素的原子个数比为22:5 |
下图是一定条件下某反应的微观示意图。说法错误的是
| A.反应前后原子种类、数目不变 |
| B.反应中甲、乙两种物质的物质的量之比为2∶1 |
C.反应中“ ”表示原子的元素由化合态转化为游离态 ”表示原子的元素由化合态转化为游离态 |
| D.反应物和生成物都是由分子构成的 |
右图中,①、④是紫色石蕊溶液润湿的棉球,②、③是石蕊溶液染成紫色的干燥棉球。能说明CO2密度大于空气且能与水反应的现象是
| A.①变红,③不变红 | B.④变红,②不变红 |
| C.①、④变红,②、③不变红 | D.④比①先变红,②、③不变红 |
右图表示一定质量氯酸钾和二氧化锰受热过程,某变量y随加热时间的变化趋势,纵坐标表示的是
| A.固体中二氧化锰的质量 | B.产生氧气的质量 |
| C.固体中氧元素的质量分数 | D.固体中钾元素的质量分数 |
t℃时,在饱和硫酸铜溶液中加入a g无水硫酸铜,恢复至原温度可析出b g硫酸铜晶体。说法正确的是
| A.溶液中溶剂的量不变,颜色不变 |
| B.b g硫酸铜晶体中含硫酸铜的质量大于a g |
| C.溶质质量分数不变,溶解度变小 |
| D.(b-a)g表示原溶液损失的溶质质量 |
一定质量的木炭在氧气和氮气的混合气体的密闭容器中燃烧产生CO和CO2,且反应后测得混合气体中碳元素的质量分数为24%,则其中氮气的质量分数不可能为
| A.10% | B.20% | C.30% | D.40% |
化学与生活息息相关。
① 煤、 和天然气是三大化石燃料。
② 生活中常用到“含氟牙膏”、“高钙牛奶”等,这里的氟、钙是指 (填“单质”、“分子”、“原子”或“元素”)。
③ 厨房炒菜时,在客厅能闻到菜香味的主要原因是 。
④ 书写重要的材料常使用碳素墨水的原因是 。
⑤ 打开汽水瓶盖,发现有大量的气泡逸出,原因是 ,气体的溶解度减小。
⑥ 我国新版饮用水标准中要求使用消毒剂一氯胺(NH2Cl),其摩尔质量为 , 0.1mol的NH2Cl中约含氢原子 个(用科学计数法表示),含氮元素的质量 g。
水是人类宝贵的自然资源,与人类的生产、生活密切相关。
① 关于“H2O”的说法中,正确的是 。
Ⅰ.表示水这种物质 Ⅱ.表示两个氢原子和一个氧原子
Ⅲ.表示一个水分子 Ⅳ.表示一个水分子由一个氢分子和一个氧原子构成
② 人发热的时候,常常用冰块来降温,是利用了水的 性质。
③ 实验室电解水(如图1),与直流电源正极相连的试管中生成的气体是 ,反应的化学方程式为 ,该实验证明水是由 组成的。

④ 海水淡化可缓解淡水资源匮乏的问题。图2为太阳能海水淡化装置示意图。
水变成水蒸气的过程中,不发生变化的是
Ⅰ.分子大小 Ⅱ.分子种类 Ⅲ.分子间隔
⑤ 某水厂净化水的大致流程如下:

水经过沙滤池,除去的杂质是 ;炭滤池中活性炭的主要作用是 。
⑥ 水常用来配制溶液。现将100g 95%的乙醇溶液稀释为75%的乙醇溶液用于医用消毒,需要加水的体积为 mL。(精确到0.1)
右下图牵手表示相邻的两种物质在一定条件下会发生化学反应。A、B、C、D和E分别是木炭、镁条、二氧化碳、铁丝和氧气中的一种物质,其中B在通常情况下不助燃不可燃,但是A可以在B中燃烧,C具有吸附性。

① 写出物质的化学式:B ,E 。
② A和B反应的化学方程式是 。
③ B和C反应过程中,B作 (填“氧化剂”或”还原剂”)。
④ E在D中燃烧的现象是 。
⑤ 图中的牵手关系中,属于化合反应的个数为 。
⑥ 除了图中的牵手关系外,还能互相牵手的请用化学方程式表示 。
如图是甲、乙、丙三种固体物质的溶解度曲线。

① P点的含义 。
② 要使接近饱和的甲溶液变成饱和溶液,可采用的方法有 (写出一种)。当甲溶液中含有少量乙时,可采用 的方法提纯甲。
③ t2℃时,将30 g甲物质放入50 g水的烧杯中,所得溶液溶质的质量分数为 (精确到0.1)。若烧杯内物质升温到t3℃(不考虑水蒸发),溶液中变化的是 。
Ⅰ.溶质的质量 Ⅱ.溶剂的质量 Ⅲ.溶质的质量分数
④ t2℃时,在含有50 g水的甲和乙的饱和溶液中,分别加入m g甲和m g乙,升温至t3℃,甲完全溶解,乙仍有剩余,则m的质量范围是 。
请根据下图回答问题:

① 将图1和图6连接可以制取氧气,反应的化学方程式为 ,证明氧气已经集满的现象是 。若用图6收集一瓶含1/4空气的氧气,操作的方法是 。
② 图2中仪器A的名称为 ,它在装置中的主要作用是 。甲同学用图2和图 连接来制取二氧化碳,装置中加入盐酸的量至少要 。
③ 乙同学在图2基础上增加了一块带孔的隔板(如图3),则大理石应放在 处(填“a”或“b”),该装置中加入盐酸的量至少要 ;若加入盐酸过多,则有可能产生的后果是 ,要使反应停止,其操作是 。
④ 丙同学用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为 。反应前他事先往试管中加入了少量的水,甲同学由此产生了疑问,提出了猜想:
猜想1:加水可以起到稀释的作用,使反应速度变缓。
猜想2:……
甲同学根据猜想进行了实验:每次取15mL 15%的过氧化氢溶液,稀释成不同溶质
质量分数,在其他条件相同的情况下进行实验。记录数据如下:
| 实 验 |
1 |
2 |
3 |
4 |
5 |
| 过氧化氢溶液溶质质量分数 |
1% |
3% |
5% |
10% |
15% |
| MnO2粉末用量/g |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
| 收集到500mL气体时所用时间/s |
560 |
186 |
103 |
35 |
12 |
| 反应后液体温度/℃ |
26 |
38 |
43 |
59 |
71 |
根据表中数据可知:过氧化氢溶液的溶质质量分数对反应速度的影响是 。
甲同学的猜想2是:加水可以 。
某学习小组准备探究气体的测定和数据处理方法。
【提出问题】利用碳酸钙与稀盐酸反应来测定生成CO2的量。
【实验设计】通过下列两个实验分别测定CO2的质量和体积。

实验一 实验二
【分析处理】
实验一:
① 将小烧杯中的稀盐酸分几次加入到大烧杯中,并不断搅拌,判断反应后盐酸过量的依据是 。
② 若稀盐酸足量,计算理论上能产生二氧化碳的物质的量 。(根据化学方程式进行计算)
实验二:
③ 先连接好装置,再 (填操作),然后装好药品,最后将20mL稀盐酸快速推入锥形瓶中。若缓慢推入,则可能造成的后果是 。
④ 实验记录如下(表中数据在相同温度、相同压强条件下测定):
| 时间/min |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 注射器读数/mL |
60.0 |
85.0 |
88.0 |
89.0 |
89.5 |
89.8 |
89.9 |
90.0 |
90.0 |
90.0 |
根据以上实验过程和数据综合分析,最终生成CO2的体积是 mL。
【反思与评价】
⑤ 经过分析,下列说法错误的是 。
A.实验一的操作简单,便于读数
B.实验一最终得到的数据和通过计算得出的理论值完全相等
C.实验二在密闭体系内反应,更环保
D.实验二中若将碳酸钙粉末改成块状的大理石,更安全
用碳、一氧化碳还原氧化铜的仪器、装置如下图。(连接装置的橡皮管省略)



请回答以下问题:
① 一氧化碳还原氧化铜的实验中,除A装置外,还需选用的仪器、装置组合是 (填字母),选用该仪器、装置的目的是 、 。
② 碳还原氧化铜的实验中(将A中的酒精灯换成酒精喷灯),反应的化学方程式是 。
③ 用碳和一氧化碳还原氧化铜的两个实验中,装置A中观察到的现象是 。
④ 现有一包混有少量碳粉的氧化铜粉末,为了测定其碳粉的质量分数,称取m g样品进行高温加热,实验过程中获取两组数据:
Ⅰ.反应前后仪器a中质量减少x g;
Ⅱ.吸收生成物的仪器中质量增加y g。
假设反应充分,称量准确,你认为应选择哪组数据进行计算会更为合理准确?你的理由是 ,请列出计算碳粉质量分数的式子 。(用m、x、y表示)。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号