火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层 析 G.过滤 |
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B _ ___,D 。
(2)将含lmol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该
化合物化学式为__ __。
(3)C常用作净水剂,用离子方程式表示其净水原理______ __。
(4 )在A溶液中加入少量澄清石灰水,其离子方程式为___ _。
)在A溶液中加入少量澄清石灰水,其离子方程式为___ _。
(5)向20mL 2mol/L C溶液中加入30mL E溶液,充分反应后得到0 .78g沉淀,
.78g沉淀,
则E溶液的物质的量浓度可能是 moI·L-1
有机物F(C13H16O2)是一种芳香酯,可用作香精的调香剂。如下图是该有机物的合成路线:
请回答下列问题:
(1)反应②中另 加的试剂是 ;反应⑤的一般条件是: 。
加的试剂是 ;反应⑤的一般条件是: 。
(2)反应③的化学方程式为 。
(3)反应⑦的化学方程为 。
(4)上述合成路线中属于取代反应的是 (填编号)。
(5)C的同分异构体有多种,其中能发生水解反应的有机物有 种。
已知X、Y、Z、W为四种短周期元素,其原子序数依次增大,且由这些元素所组成的单质在常温下均呈气态。X、Y、W处于不同 周期,且在一定条件下其单质能发生反应:
周期,且在一定条件下其单质能发生反应: 甲、乙可化合生成离子化合物丙。试回答下列问题:
甲、乙可化合生成离子化合物丙。试回答下列问题:
(1)W元素在周期表中的位置是 周期、 族;Y2的电子式是 。
(2)X、Y、Z原子半径由大到小顺序为 (写元素符号);丙的水溶液呈酸性,用离子方程式表示其原因 。
(3)X、Z可组成四原子化合物丁,其化学式为 ,此分子中含有的共价键类型为 。
(4)X、Y组成的液态化合物Y2X416g与足量的丁反应生成Y2和液态水,放出QkJ(Q>0)的热量,请写出该反应的热化学方程式 ;Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为 。
下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
(1)单质B的化学式是 ,写出物质A的一种用途 。
(2)写出单质B与强碱溶液反应的离子方程式 ,
写出由沉淀J生成 H溶液的离子方程式 。
(3)写出白色沉淀L变为红褐色沉淀G的化学反应方程式
。
(12分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A_____________;H ______________; G___________;乙____________。
(2)写出下列反应的化学方程式:
反应①___________________________________________________________;
反应②___________________________________________________________。
(4分)有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、NO3-、 Cl-、I-,取该溶液进行如下实验:
Cl-、I-,取该溶液进行如下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
⑶取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的上述离子有 ,不能确定是否存在上述的离子有______________。
A~H及X均为中学化学常见物质,X是一种金属单质,A、B是周期表中相邻元素,且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)
试回答下列问题:
(1)写出 C物质的化学式: 。
(2)在上述①~⑤反应中肯定不属于氧化还原反应的是 (填编号)。
(3)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:

 。
。
(4)请写出C腐蚀铜板制印刷电路板的离子方程式: ____ 。
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
| |
Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第______________周期,___________族;
(2)XW2的电子式为_______________;
(3)Y的最高价氧化物的化学式为________________;
(4)W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
 2SO2(g) + O2(g) = 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= —99kJ·mol-1.请回答下列问题:
2SO2(g) + O2(g) = 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= —99kJ·mol-1.请回答下列问题:
 (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ; (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1; (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自 身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自 身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式
、 ; (4)已知单质硫的燃烧热为296 KJ·mol-1,写出硫的燃烧热方程式:
(4)已知单质硫的燃烧热为296 KJ·mol-1,写出硫的燃烧热方程式:
计算由S(s)生成2molSO3(g)的△H KJ·mol-1。
(6分)如图A、B、C、D、E各代表铁、水、三氧化硫、盐酸和氢氧化钡中的一种物质。在常温下,相连环物质之间能发生反应,不相连环物质之间不能发生反应。且B的相对分子质量小于D。
(1)五中物质中属于氧化物的有 (填化学式)。
(2)请写出氢氧化钡的电离方程式 。
(3)请写出铁与水蒸汽在高温下发生反应的化学方程式
。
(4)请写出下列物质的化学式:B ,D (填化学式)。
(6分)氯水中含有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”)。
(2)C过程中的现象是_______________________,b过程中的离子方程式为______________________。
(3)a过程中的化学方程式为_____________________________。
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 , K值大小与温度的关系是:温度升高,K值_________________。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。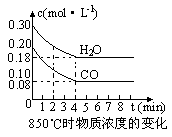
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。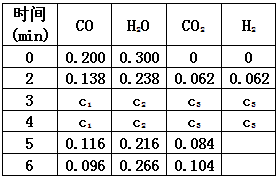
①表中3min~4min之间反应处于_________状态;
c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________ (单选),表中5min~6min之间数值发生变化,可能的原因是_________ (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度