(8分)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式______。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是______g,溶液中的c(SO42-)=______mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则X极是 (正、负极),电极反应式 。Y极的材料名称是 ,电极反应式 。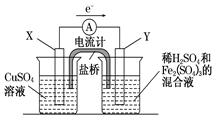
(5分)有一瓶澄清的溶液,其中可能含有H+、NH4+、Mg2+、Ba2+、Al3+、I-、NO3-、CO32-、SO42-、AlO2-,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红 色。
色。
(3)另取出部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生。
(4)取出部分上述(3)的溶液加Na2CO3溶液后,有白色沉淀生成。
根据上述实验事实可以确定,该溶液中肯定存在的离子是  ,还不能确定是否存在
,还不能确定是否存在 的离子是
的离子是  。
。
除去下表各溶液中含有的少量杂质(括号内)填写下表
| 各物质的溶液(杂质) |
除去杂质所需试剂 |
离子方程式 |
| Na2CO3(NaHCO3) |
|
|
| FeCl2(FeCl3) |
|
|
| Fe(Al) |
|
|
| SiO2(CaCO3) |
|
|
向FeCl3溶液中加入ag铜粉,搅拌使之全部溶解,再向其中加入 bg铁粉,充分反应后过滤得滤渣 cg,若已知 a>b>c,则 c克滤渣是_________。溶液中存在的阳离子是____ ________。
将0.1mol的铁铝混合物溶于100mL 2mol/L硫酸溶液中,然后再滴加1mol/LNaOH溶液。请回答:
(1) 若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。最初加入V1mLNaOH溶液的作用是_________________________;
(2)若在滴加NaOH溶液过程中,欲使Fe2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)= mL。
(3)若V1=160mL,则金属混合物中n(Fe)= mol V3= mL;(写出第(2)题的解题过程)
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-  2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是 ,电解液中H2SO4的浓度将变________,当外电路通过1mol电子时,理论上负极板的质量增加 g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式
、
(2)甲同学设计的实验 (填能或不能)验证乙炔与澳发生加成反应,其理由是
(a)使溴水褪色的反应,未必是加成反应 (b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔 (d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式是 ;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
请回答下列问题:
(1)A的化学名称是_______;
(2)B和A反应生成C的化学方程式为_____ _____,
该反应的类型为______ ___;
(3)D的结构简式为___________;
(4)D的同分异构体的结构简式为___________。
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:
N2(g)+O2(g)="2" NO(g) △H="+180" kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g )△H="-746" kJ·mol-1
)△H="-746" kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H= kJ·mol-1
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g) 2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2mol,则前5分钟的平均反应速率v(N2)为 ,平衡时H2的转化率为 ,该反应的平衡常数K= 。
2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2mol,则前5分钟的平均反应速率v(N2)为 ,平衡时H2的转化率为 ,该反应的平衡常数K= 。
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g) 2NH3(g) △H<0的平衡常数K与温度T的关系如下表:
2NH3(g) △H<0的平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
则 K1 K2(填写“>”、“=”或“<”)
K1 K2(填写“>”、“=”或“<”)
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是
(填字母)
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变 d.. 混合气体的密度保持不变
在一定条件下可实现下图所示物质之间的 变化
变化
请填写以下空白:
(1)孔雀石的主要成份是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。 上图中的F是
上图中的F是
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式
(3)图中所得G和D都为固体混合后在高温下可发生反应写出该反应化学方程式
(4)每生成1mol D同时生成 mol E。
写出下列物质的结构式
(1)CH4__________________(2)H2O_____________ (3)NH3_____________________
某微粒的结构示意图为 试回答:
试回答:
(1)当x-y=10时,该粒子为 (填“原子”或“阳离子”“阴离子”)
(2)当y=8时,该粒子可能是(任写三种): 、 、 。
(3)写出y=3的元素最高价氧化物与y=7的元素最高价氧化物对应水化物发生反应的
离子方程式 。
有X、Y、Z三种元素:
①X、Y、Z的单质在常温下均为气体;
②X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
③XZ极易溶于水,在水溶液中电离出X+和Z—,其水溶液能使蓝色石蕊试纸变红;
④每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑤Z单质溶于X2Y中,所得溶液具有漂白性。
完成下列填空:
⑴试写出其元素符号:X_______,Y_______, Z_______,以及化合物的分子式:XZ_______,X2Y_________。
⑵写出Z单质与X2Y反应的化学方程式: 。
⑶Z单质溶于X2Y中所得的新制溶液颜色为 ,该溶液具有漂白性是因为含有 。
)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:N2(g)+ O2(g)=" 2" NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H =" -" 746 kJ • mol-1
则反应CO(g) + O2(g)= CO2(g)的△H = kJ • mol-1
O2(g)= CO2(g)的△H = kJ • mol-1
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
(4) 在固定体积的密闭容器中,1.0×103 kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
①K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变