[辽宁]2011-2012学年度辽宁省庄河六高中高二下学期开学初考试化学试卷
下列有机物的命名正确的是( )
| A.3,3-二甲基丁烷 | B.3-甲基-2-丁烯 |
| C.2-乙基丁烷 | D. 名称为1,4-二甲苯 名称为1,4-二甲苯 |
已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
| A.+519.4kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4kJ·mol-1 |
下列推论正确的是
| A.S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>b |
| B.C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ/mol,则可判定金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的稀溶液与足量稀盐酸完全反应,放出的热量为28.7 kJ |
| D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0,则该反应任何温度下都能自发进行 |
下列说法中有明显错误的是
| A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.活化分子之间发生的碰撞不一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加入适宜的催化剂,使分子能量增加从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率 |
在恒容密闭容器中A(g)+3B(g)  2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
| A.容器中混合气体的平均相对分子质量增大 |
| B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| C.正反应速率和逆反应速率都变小,C的百分含量增加 |
| D.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则
m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
下列关于电解质溶液的叙述中正确的是
| A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B.常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH )前者小于后者 )前者小于后者 |
| D.常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1,则此溶液可能是盐酸 |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L |
| B.NaHCO3溶液中:c(OH-) = c(H+) + c(H2CO3)-c(CO32—) |
| C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+) |
| D.Na2S溶液中:2 c(Na+)= c(S2—) + c(HS—)+ c(H2S) |
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为
A. |
B. |
C. |
D. |
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.24 g某金属,下列说法正确的是
| A.甲池b极上析出金属银,乙池c极上析出某金属 |
| B.甲池a极上析出金属银,乙池d极上析出某金属 |
| C.某盐溶液可能是CuSO4溶液 |
| D.某盐溶液可能是Mg(NO3)2溶液 |
下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④HF与水能以任意比混溶
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥常温下0.1mol/L的HF溶液的pH为2.3
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
| A.①⑥ | B.①②⑦ | C.③④⑥ | D.②③⑤ |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16.下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于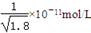 |
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是
| A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗 |
| B.酸式滴定管用蒸馏水洗后,又用标准溶液润洗 |
| C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失 |
| D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确 |
25℃时,在水电离出的C(H+)=1×10-12摩/升的溶液中,一定能大量共存的是 ( )
| A.Al3+、NH4+、SO42-、Cl- | B.Mg2+、K+、SO42-、HCO3- |
| C.K+、Na+、Cl-、SO42- | D.K +、Cl-、Na+、PO43- |
某温度下在,密闭容器中发生如下可逆反应:2M(g)+N(g)  2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
| A.20% | B.40% | C.60% | D.80% |
25℃时,若体积Va、PH=a的某一元强酸溶液与体积Vb、pH=b的某一元强碱溶液混合,恰好中和,且已知Va<Vb,a=0.5b,a的取值范围是( )
| A.7/2<a<14/3 | B.7<a<14 | C.3<a<5 | D.9/2<a<15/2 |
下列图示与对应的叙述相符的是 ( )
图1 图2 图3 图4
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正 > v逆 |
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH + 3O2 =" 2" CO2 + 3H2O,电池构造如下图。下列关于该电池的说法不正确的是
| A.放电过程中,电源内部的H+从正极区向负极区迁移 |
| B.通入乙醇的电极是负极 |
C.该电池的正极反应为:4H+ + O2 + 4 = 2H2O = 2H2O |
| D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L |
(1)将各有机物的序号填到对应分类中①CH3CH2CH3 ②CH2=CH—CH3 ③CH3COOCH3 ④H3C—OH⑤CH3CH2COOH 醇:_______ 羧酸:_______ 烷烃: ______
⑥ 烯烃:_______ 酯:_______ 醛:_______
烯烃:_______ 酯:_______ 醛:_______
(2)如下图所示的核磁共振谱图是1-丙醇: 和2-丙醇:
和2-丙醇: 中的一种,根据图中信息,其结构简式为:
中的一种,根据图中信息,其结构简式为:
)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:N2(g)+ O2(g)=" 2" NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H =" -" 746 kJ • mol-1
则反应CO(g) + O2(g)= CO2(g)的△H = kJ • mol-1
O2(g)= CO2(g)的△H = kJ • mol-1
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
(4) 在固定体积的密闭容器中,1.0×103 kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
①K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
某小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
已知某二元酸(化学式用H2RO4表示)在水中的电离方程式为: H2RO4=H++HRO4-;HRO4 H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________
H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________
(用离子方程式和必要的文字说明)。
(2)Na2RO4溶液湿 (填“酸性”、“中性”或“碱性”),理由是__________ (用离子方程式表示)
(3)如果25℃时,0.1 mol/L的NaHRO4溶液中,c(RO42-)=0.029 moL/L,则0.1mol/L H2RO4溶液中c(RO42-) 0.029 mol/L(填“<”、“>”或“=”),理由是 。
(4)25℃时,0.1 mol/L的NaHR04溶液中,各离子浓度由大到小的顺序是 。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH。
(2)电解池阳极能同时发生了两个电极反应(阳极上还会产生微量气泡),电极反应式分别是:Ⅰ.___________________________;Ⅱ.___________________________________;
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。
①负极的电极反应是______________________;
②正极的电极反应是________________________________;
③为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_________________;
 粤公网安备 44130202000953号
粤公网安备 44130202000953号