(1)将各有机物的序号填到对应分类中①CH3CH2CH3 ②CH2=CH—CH3 ③CH3COOCH3 ④H3C—OH⑤CH3CH2COOH 醇:_______ 羧酸:_______ 烷烃: ______
⑥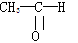 烯烃:_______ 酯:_______ 醛:_______
烯烃:_______ 酯:_______ 醛:_______
(2)如下图所示的核磁共振谱图是1-丙醇: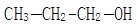 和2-丙醇:
和2-丙醇: 中的一种,根据图中信息,其结构简式为:
中的一种,根据图中信息,其结构简式为:
(1)将各有机物的序号填到对应分类中①CH3CH2CH3 ②CH2=CH—CH3 ③CH3COOCH3 ④H3C—OH⑤CH3CH2COOH 醇:_______ 羧酸:_______ 烷烃: ______
⑥ 烯烃:_______ 酯:_______ 醛:_______
烯烃:_______ 酯:_______ 醛:_______
(2)如下图所示的核磁共振谱图是1-丙醇: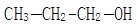 和2-丙醇:
和2-丙醇: 中的一种,根据图中信息,其结构简式为:
中的一种,根据图中信息,其结构简式为: