[云南]2011-2012学年云南蒙自高中高二上学期10月教学质量监测化学试卷
下列说法正确的是 ( )
| A.需要加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件下一定能发生反应 |
| C.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
| D.吸热反应只能在加热的条件下才能进行 |
下列说法正确的是 ( )
| A.热化学方程式的计量数只表示分子的个数 |
| B.热化学方程式中只需标明生成物的状态 |
| C.反应热指的是反应过程中放出或吸收的热量 |
| D.有能量变化的一定是化学变化 |
在2A+B= 3C+4D中,表示该反应速率最快的是( )
A.V (A) = 0.5mol·L-1·S-1
B.V (B) =" 0.3" mol·L-1·S-1
C.V (C) = 0.8mol·L-1·S-1
D.V (D)=" 1" mol·L-1·S-1
能增加反应物分子中活化分子百分数的是( )
| A.升高温度 | B.扩大容积的体积 | C.增大压强 | D.增加浓度 |
已知反应A + 3B =" 2C" + D在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L·min),则此段时间内以C的浓度表示的化学反应速率为( )
| A.0·5mol/(L·min) | B.1mol/(L·min) |
| C.3mol/(L·min) | D.2mol/(L·min ) |
在标准状况下,将11.2L氢气在氯气中完全燃烧,放出92.4KJ热量,下列所示的热化学方程式正确的是( )
| A.H2(g)+Cl2(g)=1/2HCl(g) ΔH=92.4KJ/mol |
| B.H2(g)+Cl2(g)=1/2HCl(g) ΔH=-92.4KJ/mol |
| C.H2(g)+Cl2(g)=2HCl(g) ΔH=-184.8KJ/mol |
| D.H2(g)+Cl2(g)=2HCl(l) ΔH=184.8/mol |
在25℃、1.01×105Pa时,1gCH4燃烧时生成CO2与液态H2O,放出55.6kJ的热量,则CH4的燃烧热为 ( )
| A.55.6kJ/mol | B.444.8kJ/mol | C.889.6kJ/mol | D.-889.6kJ/mol |
在一定条件下,密闭容器中进行的反应:H2 + I2  2HI对于下列示意图所表示的涵义解释正确的是( )
2HI对于下列示意图所表示的涵义解释正确的是( )
| A.反应开始时,容器中投入了H2、I2、HI三种气体 |
| B.0到t1时刻,反应向逆反应方向进行 |
| C.t1时刻后,正、逆反应的速率均为零 |
| D.t1时刻后,H2、I2、HI三种气体的浓度达到相等 |
肯定能使化学反应速率加快的方法是 ( )
①升高温度②加入催化剂③增加反应物浓度④将固体块状反应物磨成粉末
| A.② | B.①② | C.①③④ | D.①②③④ |
已知某可逆反应在密闭容器中进行: A(g)+2B(g)  C(g)+D(s) 正反应为放热反应。图曲线a代表一定条件下该反应的过程。若使a 曲线变为b曲线,可采取的措施是( )
C(g)+D(s) 正反应为放热反应。图曲线a代表一定条件下该反应的过程。若使a 曲线变为b曲线,可采取的措施是( )
| A.增大A的浓度 | B.缩小容器的容积 |
| C.加入催化剂 | D.升高温度 |
对于反应N2(g)+3H2(g)  2NH3(g),能增大正反应速率的措施是( )
2NH3(g),能增大正反应速率的措施是( )
| A.通入大量H2 | B.增大容积 | C.移去部分NH3 | D.降低体系温度 |
在密闭容器中进行2SO2(g)+ O2(g)  2SO3(g)(
2SO3(g)( H﹤0)。下图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是 ( )
H﹤0)。下图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是 ( )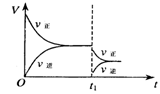
| A.使用催化剂 | B.减小生成物的浓度 |
| C.降低体系温度 | D.增大容器的体积 |
NO和CO都是汽车尾气里的有害物质,它们能缓慢起反应,生成N2和CO2,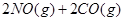

 对此反应,下列叙述正确的是( )
对此反应,下列叙述正确的是( )
| A.使用催化剂不改变反应速率 | B.升高温度能加快反应速率 |
| C.降低压强能增大反应速率 | D.改变压强对反应速率无影响 |
已知:C(s)+CO2(g) 2CO(g)△H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是( )
2CO(g)△H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是( )
| A.升高温度和减小压强 | B.降低温度和减小压强 |
| C.降低温度和增大压强 | D.升高温度和增大压强 |
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
强酸和强碱在稀溶液中的中和热可表示为:
H+(aq) + OH-(aq) = H2O(l); △H= -57.3kJ·mol-1,又知在溶液中反应有:
CH3COOH(aq) + NaOH(aq)= CH3COONa(aq) + H2O(l);△H=" -" Q 1 kJ·mol-1, H2SO4(浓)+ NaOH(aq) =
H2SO4(浓)+ NaOH(aq) =  Na2SO4(aq) + H2O(l) ;△H=" -" Q 2 kJ·mol-1
Na2SO4(aq) + H2O(l) ;△H=" -" Q 2 kJ·mol-1
HNO3(aq) + KOH(aq) KNO3(aq)+ H2O(l) ; △H =" -" Q 3 kJ·mol-1,
KNO3(aq)+ H2O(l) ; △H =" -" Q 3 kJ·mol-1,
则Q1、Q2、Q3的关系正确的是 ( )
| A.Q 1 =" Q" 2 =" Q" 3 | B.Q 2 > Q 1 > Q 3 | C.Q 2 =" Q" 3 > Q 1 | D.Q 2 > Q 3 > Q 1 |
已知下列热化学方程式:(l) C(s)+1/2O2(g)=CO(g) △H =△H1
(2) =2H2O(g) △H=△H2
=2H2O(g) △H=△H2
由此可知 C(s)+ H2O(g) == CO(g) + H2(g) ΔH3。则 ΔH3等于 ( )
| A.△H1-△H2 | B.△H1- △H2 △H2 |
| C.2△H1-△H2 | D. △H2 -△H1 △H2 -△H1 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述正确的是 ( )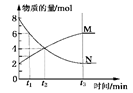
A.反应的化学方程式为:2M N N |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g) + B(g) xC(g) + 2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是 ( )
xC(g) + 2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是 ( )
| A.x的值为2 | B.A的转化率为40% |
| C.B的平衡浓度为0.8 mol·Lˉ1 | D.D的体积分数为20% |
某温度下,容积一定的密闭容器中进行如下可逆反应:

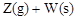 ;
; ,下列叙述正确的是( )
,下列叙述正确的是( )
| A.加入少量W,逆反应速率增大 |
B.平衡后加入X,上述反应的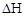 增大 增大 |
| C.升高温度,平衡逆向移动 |
| D.混合气体密度不变,不能作为反应达到平衡的标志 |
反应CO(g)+2H2(g) CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )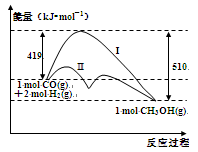
| A.反应物的总能量大于生成物的总能量 |
| B.加入催化剂,该反应的△H变小 |
| C.如果该反应生成液态CH3OH,则△H变大。 |
| D.该反应的△H =+91 kJ/mol |
在容积可变的密闭容器中,2molN2和6molH2在一定条件下反应,达到平衡时,H2的转化率为40%,则平衡时氨气的体积分数接近于 ( )
| A.10% | B.15% | C.20% | D.25% |
已知:2H2(g)+O2(g)=2H2O(l) 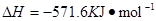 ;
;
CH4 (g)+2O2(g)=CO2+2H2O(l) 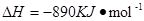 ;
;
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3241.6KJ。则原混合气体中H2与CH4的物质的量之比是(( )
| A.2∶3 | B.1∶3 | C.1∶1 | D.1∶4 |
在一密闭容器中,反应m A(g)+ n B(g) p C(g),达到平衡时,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B的浓度为原来的2.5倍,下列说法正确的是( )
p C(g),达到平衡时,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B的浓度为原来的2.5倍,下列说法正确的是( )
| A.平衡向正反应方向移动 | B.物质A的转化率增大 |
| C. m + n < p | D.物质C的体积分数增大 |
在密闭容器中进行的反应C(s)+ H2O(g)  CO(g) + H2(g)
CO(g) + H2(g)  ,改变下列条件:(1)若升高温度,正反应速率 ,逆反应速率 (填增大或减小或不变),平衡 移动。
,改变下列条件:(1)若升高温度,正反应速率 ,逆反应速率 (填增大或减小或不变),平衡 移动。
(2)若增大CO的浓度,平衡 移动,H2O(g)的转化率 (填增大或减小或不变)。
 2SO2(g) + O2(g) = 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= —99kJ·mol-1.请回答下列问题:
2SO2(g) + O2(g) = 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= —99kJ·mol-1.请回答下列问题:
 (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ; (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1; (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自 身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自 身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式
、 ; (4)已知单质硫的燃烧热为296 KJ·mol-1,写出硫的燃烧热方程式:
(4)已知单质硫的燃烧热为296 KJ·mol-1,写出硫的燃烧热方程式:
计算由S(s)生成2molSO3(g)的△H KJ·mol-1。
(1)在一定温度下,将2molA和2molB两种气体混合于2L密闭容器中,发生反应:3A(g)+2B(g) x C(g)+2D(g)ΔH <0 ,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断:
x C(g)+2D(g)ΔH <0 ,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断: ① x值等于 ; ② B的平衡浓度为 。
① x值等于 ; ② B的平衡浓度为 。 ③ A的转化率为 。
③ A的转化率为 。
④由于条件改变而引起反应速率和化学平衡的变化情况,a---b过程中改变的条件可能是 ;b----c过程中改变的条件可能是 ;之后若增大压强时,请把反应速率变化情况画在上图中的c-----d处(标明V正和V逆)该条件下反应建立新平衡后体系中混合气体的平均相对分子质量 (填“增大”或“减小”或“不变”)。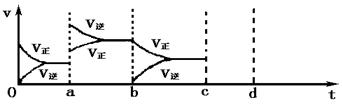
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: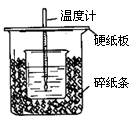
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
控制变量法是研究化学变化规律的重要思想方法,请仔细观察表中100mL稀盐酸和2g Zn反应的实验数据:
| 实验序号 |
锌的 状态 |
C(HCl) mol/L |
溶液温度℃ |
锌消失时间(s) |
|
| 反应前 |
反应后 |
||||
| 1 |
粒状 |
0.5 |
20 |
39 |
400 |
| 2 |
粒状 |
0.6 |
20 |
41 |
310 |
| 3 |
粉末 |
0.5 |
20 |
40 |
280 |
| 4 |
粒状 |
0.8 |
20 |
40 |
200 |
| 5 |
粉末 |
0.8 |
20 |
40 |
30 |
| 6 |
粒状 |
1.0 |
20 |
40 |
120 |
| 7 |
粒状 |
1.0 |
30 |
50 |
40 |
| 8 |
粒状 |
1.2 |
20 |
40 |
90 |
| 9 |
粒状 |
1.2 |
25 |
45 |
40 |
分析并回答下列问题:
(1)本反应属于 反应(填“吸热”或“放热”)。
(2)实验6和7表明: 对反应速率有影响, 反应速率越快,能表明同一规律的还有 (填实验序号);
(3)根据实验1、2、4、6、8可以得出的条件对反应速率的影响规律是: ;
(4)本实验中影响反应速率的其他因素还有 ,能表明这一规律的实验序号是1、3与 。
 ,经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol /L,求:
,经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol /L,求: 粤公网安备 44130202000953号
粤公网安备 44130202000953号