“禁止化学武器组织”获得2013年诺贝尔和平奖。Cl2是最早作为化学武器在战争中使用的有毒气体,但Cl2及其化合物在生活、生产中有广泛的用途,请回答下列与氯有关的问题:
(1)请画出氯离子结构示意图: 。
(2)漂白粉是灾后饮用水常用消毒剂,写出工业上制漂白粉的化学反应方程式: 。
(3)FeCl3可用作净水剂。室温时在FeCl3溶液中逐滴加入NaOH溶液,当pH=3时就开始产生沉淀,则原FeCl3溶液中c(Fe3+)大于 mol/L(已知:Ksp[Fe(OH)3=4.0×10-39])
(4)“84”消毒液的有效成分为NaClO,1mol Cl2 与含2mol NaOH溶液反应后,离子浓度由大到小的顺序为 。
(5)ClO2是高效水处理剂,用NaClO2与NCl3反应可以制得ClO2。已知在NCl3分子中成键原子共用电子对偏向于N原子,有关反应式为:
NaClO2 + NCl3 +H2O→ClO2↑+NH3↑+ NaCl + (未配平)。
①该反应中未知的生成物是 (填化学式)。
②该反应中被氧化的原子与被还原的原子的物质的量之比为 。
向100 mL 3 mol·L-1 NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质若是单一成分,可能是 或 ;
如果是多种成分,可能是 或 。
(2)在上述所得溶液中,逐滴缓慢滴加1 mol·L-1盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示:

①加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式 。
②产生的CO2在标注状况下的体积为 mL。
某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,其中As是产物之一。
(1)写出并配平该反应的化学方程式 ______________
(2)在该反应中,得电子的物质是 (填化学式),被氧化的元素是 (填元素符号);
(3)在该反应中,每转移1 mol电子,消耗(生成)HCl mol;
(4)下列叙述正确的是_____________(填写序号)。
| A.在相同条件下,VIIA族元素阴离子的还原性从上到下逐渐增强 |
| B.在反应KIO3 + 6HI =" KI" + 3I2 + 3H2O中,每生成3mol I2转移的电子数为6NA |
| C.含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl- |
| D.在上述反应中,氧化性:SnCl2 >As还原性:H3AsO3>H2SnCl6 |
CO是水煤气的主要成份之一,是一种无色剧毒气体,根据信息完成下列各题
Ⅰ、已知下列热化学方程式
2C(s) + O2(g) = 2CO(g) △H = -221kJ/mol
C(s) + O2(g) = CO2(g) △H = -393kJ/mol
24g单质碳在不足量的O2中燃烧时,生成等物质的量的CO和CO2气体,则和24g单质碳完全燃烧生成CO2相比较,损失热量_________kJ
Ⅱ、850℃时,在10L体积不变的容器中投入2molCO和3molH2O,发生如下反应:
CO(g) + H2O(g) CO2(g) + H2(g),当CO的转化率达60%时,反应达平衡
CO2(g) + H2(g),当CO的转化率达60%时,反应达平衡
(1)850℃时,该反应的平衡常数为_________
(2)该条件下,将CO和H2O都改为投入2mol,达平衡时,H2的浓度为_________mol/L,下列情况能说明该反应一定达平衡的是_________
| A.V正(CO) = V逆(CO2) |
| B.气体的密度不再随时间改变 |
| C.CO的体积分数不再随时间改变 |
| D.气体的平均摩尔质量不再随时间改变 |
Ⅲ、为防止CO使人中毒,一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇——氧化钠,其中O2-可以在固体ZASICON中自由移动,则:

(1)该原电池中通入CO的电极为_________极,该电极的电极反应式为___________________
(2)通空气一极的电极反应式为____________________________________
I.氮及其化合物在很多方面有重要的用途。
(1)氮的氧化物有多种。现有NO和NO2的混合气体,其中N 、O元素质量之比为7:12,则该混合气中NO和NO2的物质的量之比为 。
(2)氨气的实验室制法有多种,若不加热,制取氨气所用试剂可以用浓氨水和氢氧化钠固体,产生氨气的原因是: ;氨气的检验方法是: 。

通过如图装置(尾气处理装置已略去)验证了氨有还原性,硬质玻璃管中氨发生催化氧化反应的化学方程式为_________________________。
(3)氮的一种氢化物肼(即N2H4)用作发射卫星的燃料。
已知: N2 + 2O2 = 2NO2 N2H4 + O2 = N2 + 2H2O
发射卫星用气体肼为原料,以NO2气体为氧化剂。若1 g气体肼与NO2气体反应生成氮气和水蒸气放出a kJ热量,写出反应的热化学方程式______________________。反应中生成N2质量为42g,则转移电子的物质的量为________________。
II.已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
I. (1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择 (填序号)。
①1mL 0.01 mol·L—1的碘水 ②1mL 0.001 mol·L—1的碘水
③4mL 0.01 mol·L—1的Na2S2O3溶液 ④4mL 0.001 mol·L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32—)=
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) 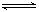 CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为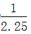 ,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
| |
0min |
5min |
10min |
| CO |
0.01 |
|
0.0056 |
| H2O |
0.01 |
|
0.0156 |
| CO2 |
0 |
|
0.0044 |
| H2 |
0 |
|
0.0044 |
(1)请计算5min时H2O的平衡浓度__________。
(2)CO的平衡转化率为____________。
(3)若5min~10min只改变了某一条件,该条件是__________,如何改变的___________。
Cl2是重要的化工原料。
(1)写出用Cl2制备漂白液的离子方程式______________________。

(2)图1所示的催化剂循环可实验用O2将HCl转化为Cl2,其中反应①为2HCl(g)+CuO(s) H2O(g)+CuCl2(s) ΔH1,反应②消耗1mol O2的反应热为△H2,则总反应生成1mol Cl2(g)的焓变为 (用ΔH1和ΔH2表示)。
H2O(g)+CuCl2(s) ΔH1,反应②消耗1mol O2的反应热为△H2,则总反应生成1mol Cl2(g)的焓变为 (用ΔH1和ΔH2表示)。
(3)实验室模拟用O2将HCl转化为Cl2的总反应
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl—T曲线如图2所示,则总反应的△H_________0 ,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 ,简要说明理由: 。
②在上述实验中若压缩体积使压强增大,在图2中画出相应ɑHCl—T曲线的示意图。
③为提高HCl的平衡转化率下列措施中可行的是 。
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
常温下有浓度均为0.5mol・L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。该物质水解的离子方程式为 。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中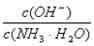 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:
(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是_______,该操作中所用的仪器有铁架台(带铁圈)、烧杯等,还需要使用的仪器有___________,溶液中多余的纯碱可以加_________试剂来除去。
(2)上述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,其原因是_________。整个过程中循环利用的物质是________(用化学式表示)。
(3)(4)若采用上述流程生产106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不得少于_____L(不考虑二氧化碳的回收利用)。
镍(28Ni)在金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为___________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:________、___________、_________。
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构示意图如图1所示.则该晶体的化学式为 _________。

(4)下列反应常用来检验Ni2+,请写出另一产物的化学式。

与Ni2+配位的N原子有______ 个,该配合物中存在的化学键有__________(填序号)。
A.共价键 B 离子键 C 配位键 D 金属键 E 氢键
世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)═CO2(g)△H="-394k" J/mol
2C(石墨,s)+O2(g)═CO(g)△H="-222k" J/mol
H2(g)+ 1/2O2(g)═H2O(g)△H="-242k" J/mol
则CO还原H2O(g)的热化学方程式为_________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池的工作时的负极电极反应:_______。
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应__________。


(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如上图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的________(填“正”或“负”)极,B极区电解液为_______溶液(填化学式),该离子交换膜是________(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因______________________。
对溴苯乙烯与丙烯的共聚物是一种低毒、热稳定性好的高分子阻燃剂。完成下列填空:
(1)写出该共聚物的结构简式
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体
写出该两步反应所需的试剂及条件 、
(3)将 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由上述反应可推知,由A生成对溴苯乙烯的反应条件为 .
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由上述反应可推知,由A生成对溴苯乙烯的反应条件为 .
(4)丙烯催化二聚得到2,3﹣二甲基﹣1﹣丁烯,B与2,3﹣二甲基﹣1﹣丁烯互为同分异构体,且所有碳原子处于同一平面.写出B的结构简式
设计一条由2,3﹣二甲基﹣1﹣丁烯制备B的合成路线
(合成路线常用的表示方式为:A B…
B… 目标产物)
目标产物)
完成下列各小题。

(1)系统命名: ;
(2)写出支链只有一个乙基且式量最小的烷烃的结构简式 ;
(3)指出下列各组物质之间的关系(填写编号)
A.同种物质 B.同分异构体 C.同系物
①2-甲基戊酸与丁酸 ;
②新戊烷与2,3-二甲基丙烷 ;
③对羟基苯甲醛与甲酸苯酚酯 ;
④丙烯醇与丙酮 ;
(4)写出下列化学方程式
①丙烯加聚 ;②乙醛与银氨溶液水浴加热 ;
(5)篮烷的结构如右图所示:

①篮烷的分子式为_________________;
②篮烷不具有的性质___ _____;
a.不能溶于水 b.密度大于水
c.能与溴水发生加成反应 d.常温、常压下为气体
③蓝烷的一氯代物有________种
某同学用锌铜合金粉末与等体积、等浓度的稀硫酸分别做多次实验,现列出其中四组数据,请仔细阅读,回答有关问题:
| 实验编号 |
锌铜合金质量/g |
硫酸/mL |
硫酸锌/g |
| 1 |
2.0 |
56 |
4.83 |
| 2 |
3.0 |
56 |
|
| 3 |
4.0 |
56 |
9.66 |
| 4 |
5.0 |
56 |
9.66 |
(1)上表中空缺的数据应为_______________;
(2)从上面的数据可以判断实验____________(编号)是恰好完全反应。
(3)实验1中可选用_____________(物质名称)作为已知条件,计算放出氢气的体积是___________mL(标准状况)。
(4)锌铜合金中锌的质量分数为_____________。
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式________________________;
(2)下列四种情况下,离子方程式与(1)相同的是_____________(填序号)
| A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量 |
| B.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀 |
| C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性 |
| D.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至过量 |
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用如图中的曲线表示是_______(填序号)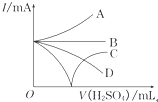
(4)向Ba(OH)2溶液中加入密度为1.165g/cm3的硫酸溶液,直到恰好完全反应为止,已知所生成的沉淀的质量等于加入的H2SO4溶液的质量,则硫酸溶液的浓度为_______mol/L。