SO2和NOx都是大气污染物。
(1)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的过程 。
(2)右表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因:

①雨后:_________________;
②风速较大时:____________________。
(3)洗涤含SO2的烟气。以下物质不能作为洗涤剂的是________(填字母序号)。
a.熟石灰 b.纯碱 c.CaCl2 d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:

①该技术的第一步反应的离子方程式为 。
②处理1 kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为 L(保留一位小数)。
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。由图可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾。

(6)氧化—还原法消除NOx的转化如下:

①反应Ⅰ为NO+O3=NO2+O2,生成11.2 L O2(标况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,反应的化学方程式是 。
(7)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是 。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为: 。
它所对应的化学反应为: 。
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填字母)。
A.="0.8" mol·L-1 B.=1.4mol·L-1 C.<1.4 mol·L-1 D.>1.4mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填字母)。
A.0.6 mol 1.0 mol 0.5 mol 1.0 mol
B.0.6 mol 2.0 mol 0 mol 0 mol
C.1.0 mol 2.0 mol1.0 mol2.0 mol
D.0.25 mol 0.5 mol 0.75 mol 1.5 mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂 C.减小容器体积 D.扩大容器体积
在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系。

试计算:
(1) NaOH溶液的物质的量浓度是 mol·L-1
(2) 当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为 L(标准状况)
(3) 当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体为 L(标准状况)。
将57.6g铜与200 m L 一定浓度的硝酸反应,铜完全溶解,产生的 NO和 NO2 混合气体在标准状况下的体积为22.4L 。
请回答:
(1) NO的体积为 ______________L,NO2的体积为________________L 。
(2) 待产生的气体全部释放后,向溶液中加入VmL a mol·L-1的NaOH 溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为______________mol·L-1(列出计算式即可)。
(3) 欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为 NaNO3至少需要30%的双氧水___________g.
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,测得溶液pH变化如右图所示。
(1)在0→t1时间内,阳极上的电极反应式为:___________________________;
(2)用离子方程式表示:a点 pH﹥7原因:__________________________;0→t1时间内,溶液pH升高比较缓慢的原因:_______________________
(3)从原溶液中溶质变化角度看,t1时刻的意义是________________________
(4)有人利用电解原理开发出了一种家用“84”消毒液(有效成分为NaClO)发生器(构造如图),在制备该消毒液时,a电极应该连接在电源的________________极上,若两个电极一种是铁、一种是石墨,则b极材料是________________。
请按要求回答下列问题:
(1)将100mL 0.3mol·L-1的NaHSO4溶液和100mL 0.2mol·L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程式:____________________________;
若向反应后的溶液中滴加2-3滴酚酞试液,则溶液的颜色变为__________________;
(2)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。若所得混合溶液为中性,则a:b=_________________
(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:____________________________;若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”“减小”或“不变”)。
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的比值将________(填“增大”、“减小”或“无法确定”)。
的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)(填“大于”、“小于”或“等于”,下同)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
高温下CuO(s)+CO(g) Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
(1)该反应的平衡常数表达式___________.
(2)在一个容积为2L的密闭容器中,1000℃时加入Cu、 CuO、CO、CO2各0.2 mol,反应经过10min后达平衡。求该时间范围内反应的平均反应速率v(CO2)﹦ 。
(3)以下措施中,能使反应(2)中的正反应速率显著加快同时不影响CO的平衡转化率的是 (填字母序号)。
A、增加CO的浓度
B、增加CuO的量
C、移出部分CO2
D、提高反应温度
E、减小容器的容积
(4)1000℃时测得在2L的密闭容器中反应体系中某时刻各物质的物质的量见下表:
| CuO |
CO |
Cu |
CO2 |
| 0.8mol |
0.4mol |
0.6mol |
0.6mol |
此时反应中正、逆反应速率的关系式是 (填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
Ⅰ.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号) 。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是 (填代号)。
A.自燃物品 B.氧化剂 C.剧毒品 D.腐蚀品
Ⅱ某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下:
实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4,溶液立即变蓝;
实验②:向实验①的溶液中加入4 L 0.5 mol/L的Na2SO3溶液,发生反应如下
SO32-+ I2+H2O→SO42-+I-+H+(未配平),恰好完全反应。
(1)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)写出实验①中发生反应的离子方式 。
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。

(1)图中共有两条曲线X和Y,其中曲线_______________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是______________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=__________mol·L-1·min-1。
②0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数Kb=_______________。
N2O4(g)的平衡常数Kb=_______________。
③25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数Kd_____________Kb(填“>”、“=”或“<”)。
N2O4(g)的平衡常数Kd_____________Kb(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________________。
| A.加入催化剂 | B.缩小容器体积 |
| C.升高温度 | D.加入一定量的N2O4 |
铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH="+646.0" kJ/mol
3Fe(s)+4CO(g) ΔH="+646.0" kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH="+172.5" kJ/mol
2CO(g) ΔH="+172.5" kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是 。
③l0 min内,反应的平均反应速率v (CO2)= 。
④欲提高该反应中CO的平衡转化率,可采取的措施是 (选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K= 。
25℃时,几种酸的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.8×10-5 |
Ka1= 4.3×10-7 Ka2= 5.6×10-11 |
3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol/L的下列四种溶液:a.Na2CO3溶液,b.NaClO溶液,c.CH3COONa溶液d.NaHCO3溶液;pH由大到小的顺序是:_______________________(填编号)。
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列各项的数值一定变小的是:__________。
A. c(H+) B. c(H+)/c(CH3COOH) C. c(H+)·c(OH-) D. c(OH-)/c(H+)
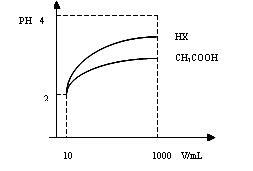
(3)体积均为10mL pH均为2的CH3COOH溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:稀释后, HX溶液中水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)
CH3COOH溶液中水电离出来的c(H+),理由是__________________________________。
(4)25℃时,测得CH3COOH与CH3COONa的混合溶液PH=6,则溶液中c(CH3COO-)- c(Na+)=_______________________。(填准确数值)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
生成氢氧化物沉淀的pH
| |
Fe(OH)3 |
Zn(OH)2 |
| 开始沉淀时 |
1.5 |
8.0 |
| 完全沉淀时 |
2.8 |
11.1 |
注: 金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)“烂版液”中溶质的主要成分是Zn(NO3)2,若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中调节pH的范围是_______________;目的是_____________________________________。
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s) +H2O(g)  CO(g) +H2(g) △H= +131.3kJ·mol-1
CO(g) +H2(g) △H= +131.3kJ·mol-1
一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是 (填字母)。
a.容器中的压强不变 b.1mol H-H 键断裂的同时断裂2molH-O键
c.v正(CO)= v逆(H2O) d.c(CO) =c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+ H2(g),得到如下三组数据:
CO2(g)+ H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①该反应的逆反应为 (填“吸”或“放’’)热反应
②若实验3要达到与实验2中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是
(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol)的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol)的变化。
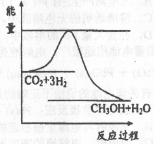
①在体积为1 L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使c(CH3OH)增大的是 (填字母)
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入l mol CO2和3 molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图:其中表示平衡混合物中CH3OH含量最高的一段时间是 ;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1 K2(填“大于”、“等于”或“小于”)。
