(1)实验测得,8g甲烷在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113kJ的热量,试写出甲烷燃烧的热化学方程式_________________________
(2)在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g) CH30H(g)
CH30H(g)
①该反应的△H_____0,___0(填“>”、“<”或“=”)
②若容器容积不变,下列措施可增加甲醇产率的是____________
| A.升高温度 |
| B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 |
| D.再充人lmolCO和3mol H2 |
(3)以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ•mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ•mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为____________
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。(已知:NH4++OH- NH3↑+H2O)
NH3↑+H2O)
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中离子的物质的量之比为______________________________。
(4)写出沉淀部分减少时的离子方程式:__________________________。
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示。
(1)写出OA段所发生反应的离子方程式:_________________________________。
(2)NaOH在吸收CO2后,所得溶液的溶质为___________________________,其物质的量浓度之比为________。
(3)产生的CO2体积(标准状况下)为___________________________________________。
(4)原NaOH溶液的物质的量浓度为________。
某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)
(1)操作a的名称为 ,所需要的玻璃仪器为 ____。
(2)固体E的成分为 ____,加入的试剂④为 __,
发生的化学方程式为 。
(3)加入试剂①的目的是 ____________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为 、冷却结晶 、 、洗涤、干燥。
(5)若废水中硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液,其中c(Cu2+)=0.1 mol/L,c(Fe2+)=0.4 mol/L,
c(SO42-)= 0.6 mol/L,已知氢离子浓度忽略不计,则c(Na+)为________。
在一定温度下,将2.4molA和1.2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应A(g)+B(g)  x C(g)+D(g) △H<0,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
x C(g)+D(g) △H<0,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________ 2min内v(B)= 。
(2)A的转化率为_________________。
(3)该反应达到平衡时,再向容器中加入1.2molA和0.6molB,再次达到平衡后,A的转化率 (填“增大”、“减小”或“不变”) 。
(4)该反应的平衡常数的表达式k = ,450℃时平衡常数_____________500℃时平衡常数(填“大于”、“小于”或“等于”) 。
(5)相同温度下,若起始时向该容器中充入0.4 mol A、0.4 mol B、0.2molC和0.2molD,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”),达到平衡时D的浓度为 。
25℃时,0.1 mol/L的HA溶液中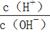 =1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是__________。
(2)HA的电离方程式是_______________________________________。
其中由水电离出的c(H+)=________mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.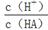 |
B.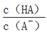 |
| C.c(H+)与c(OH-)的乘积 |
| D.c(OH-) |
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈 性,请用离子方程式解释其原因_____________,混合溶液中各离子浓度由大到小的顺序是 。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加_________mL(保留到小数点后一位)
今有①CH3COOH ②HCl ③H2SO4三种溶液。根据要求回答下列问题:
(1)当它们pH相同时,其物质的量浓度最大的是________________(填序号)。
(2)当它们的物质的量浓度相同时,其pH最小的是____________(填序号)。
(3)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_________________。(填序号)
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为_____________________;此时所得到的三种溶液的pH大小关系为______________________(填序号)。
用氯气对饮用水消毒已有百年历史。这种消毒方法会使饮用水中的有机物发生氯代反应,生成有机含氯化合物,对人体有害,且氯气本身也是一种有毒气体。世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱性高效消毒剂二氧化氯(ClO2)。目前欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,反应的化学方程式为:
___NaClO3+___HCl =___NaCl+___ClO2↑+___Cl2↑+___H2O。
(1)配平上述化学方程式。
(2)此反应中氧化剂是_______,在反应中盐酸体现的性质是_______和________。
(3)在标准状况下有4.48L氯气生成时,转移的电子数为_________mol,被氧化的盐酸的物质的量为________mol。
(4)我国研制成功用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是2NaClO2 + Cl2 = 2ClO2↑+ 2A。已知A物质是一种盐,它的化学式为_________。这一方法的优点是 。
Ⅰ、某化学反应的反应物和产物为:KMnO4 + KI + H2SO4 → MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 。
(2)如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是 。
(3)在给出的化学式上标出电子转移的方向和数目: KMnO4 + KI + H2SO4 →
(4)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是______________。
Ⅱ、向盛有KI溶液的试管中加入少许CCl4后滴加氯水, CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式:

(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为橙红色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。据此判断下列反应能否进行HBrO3+HCl→ Br2+Cl2+H2O(未配平) 。(填“能”或“否”)
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2 L。(标准状况,保留2位小数)
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为什么2NO+2CO 2CO2+N2。在密闭容器中发生该反应时,随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2。在密闭容器中发生该反应时,随温度(T)和时间(t)的变化曲线如图所示。
①T1_________(填“>”“<”或“=”)T2。
②在T2温度下,0~2s内的平均反应速率v(N2)=____________________。
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用广泛的烟气氮氧化物脱除技术。用Fe作催化剂时,在氨气足量的情况下,不同 对应的脱氮率如图所示。
对应的脱氮率如图所示。
脱氮效果最佳的 =________。此时对应的脱氮反应的化学方程式为_______________。
=________。此时对应的脱氮反应的化学方程式为_______________。
(3)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成N2 O5,其电极反应式为_____________。
氧硫化碳(COS)可替代磷化氢而被用作蒸剂。
(1)组成氧硫化碳和磷化氢的各元素中,原子半径最大的元素是___________________(填元素符号)。
(2)下列事实可用于比较C与P两种元素非金属性相对强弱的是____________(填字母)。
a.最高正化合价:P>C
b.同温同浓度的两溶液的酸性:H3PO4>H2CO3
c.沸点:PH3>CH4
(3)氧硫化碳水解及部分应用流程如下(部分产物已略去):
①已知:常温下,反应Ⅱ中每吸收1.7g H2S气体,反应放出热量4.76kJ,则该反应的热化学方程式为____________________。
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为___________。
质子交换膜燃料电池广受关注.
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气.
已知:C(s)+1/2O2(g)═CO(g) △H1=﹣110.35kJ·mol﹣1
2H2O(l)═2H2(g)+O2(g) △H2=+571.6kJ·mol﹣1
H2O(l)═H2O(g) △H3=+44.0kJ·mol﹣1
则C(s)+H2O(g)═CO(g)+H2(g) △H4= .
(2)燃料气(流速为1800mL·h﹣1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除.
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为 .
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为 .
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示.加入 (填酸的化学式)的CuO/CeO2催化剂催化性能最好.催化剂为 - HIO3,120℃时,反应1h后CO的体积为 mL.
- HIO3,120℃时,反应1h后CO的体积为 mL.

(3)图2为甲酸质子交换膜燃料电池的结构示意图.该装置中 (填“a”或“b”)为电池的负极,负极的电极反应式为
(1)在25℃、101 kPa下,1 g甲烷完全燃烧后,恢复到原状态放热Q kJ,则表示甲烷燃烧热的热化学方程式为_________________ 。
(2)肼(N2H4)一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为 。
(3)如图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入 (填序号).
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |

(4)下图是用于笔记本电脑的甲醇(CH3OH)燃料电池结构示意图,质子交换膜左右两侧的溶液均为500mL 2 mol/LH2SO4 溶液,当电池中有1mol e-发生转移时,左右两侧溶液的质量之差为 (忽略气体的溶解,假设反应物完全耗尽)。

食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知: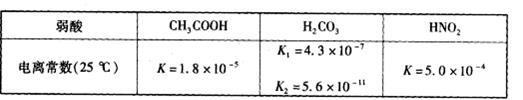
请回答下列问题:
(1)定温度下,向0.1 mol·L-1 CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
a.溶液的pH增大
b.CH3COOH的电离程度增大
c.溶液的导电能力减弱
d.溶液中c(OH- ).c(H+)不变
(2)25℃时,0.10 mol·L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____ mol·L-1。
(3)常温下,将20 mL 0.10 mol·L-1CH3COOH溶液和20 mL 0.10 mol·L-1HNO2溶液分别与20 mL 0.10 mol·L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH)_________v(HNO2)(填“>”、“<”或“:”),原因是_________.
②充分反应后.两溶液中c(CH3COO-)_________c(NO2-)(填“>”、“<”或“=”)。
(4)25 C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中
C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =__________。
=__________。
在80℃时,0.40mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:

已知:
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K= 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使c(NO2)/c(N2O4)值变小,可采取的措施有(填序号) 。
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO2 |
| C.使用高效催化剂 | D.升高温度 |
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
