400 mL NaNO3和AgNO3的混合溶液中c(NO3—)=4mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),假设电解后溶液体积仍为400 mL。试计算
(1)上述电解过程中转移电子的物质的量;
(2)电解后溶液中的C(H+)
将0℃、101KPa条件下的HCl气体44.8L,通入500ml水中(已知水的密度为:1.00g/ml),得到密度为1.13g/ml的盐酸(即氯化氢的水溶液)。
(1)求此盐酸中溶质的物质的量浓度? (计算结果保留一位小数)
(2)在此盐酸中加入250ml氢氧化钡溶液恰好完全反应,计算氢氧化钡溶液中OH-的物质的量浓度?
A、B、C为三种链烃,其碳原子数有如下组合:
| 组 别 |
碳原子数 |
||
| A |
B |
C |
|
| ① |
3 |
3 |
6 |
| ② |
3 |
3 |
4 |
| ③ |
1 |
4 |
5 |
| ④ |
2 |
4 |
4 |
| ⑤ |
5 |
2 |
7 |
| ⑥ |
2 |
2 |
4 |
试回答下列问题:
(1)若B、C为烷烃,且在一定条件下C可分解(裂化)为A和B,则满足此条件的可能组别是(填组别序号) 。
(2)若组别⑥中A为烷烃,B为炔烃,C为烯烃,且A、B、C三种物质按物质的量1︰1︰2混合,取标准状况下该混合物和过量O2组成的混合气体840mL,电火花点燃,将燃烧后的产物用过量碱石灰吸收,碱石灰增重0.93g。求:碱石灰吸收后所剩气体在标准状况下的体积。
将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO2)=0.040mol·L-1。
2SO3(g)在一定条件下达到平衡,测得c(SO2)=0.040mol·L-1。
该条件下的平衡常数_______平衡时SO2的平衡转化率________。
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 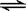 4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
将26克含有SiO2和CaCO3固体在高温下加热至质量不再改变,冷却后称重为17.2克。(已知:SiO2 + CaCO3 CaSiO3 + CO2↑,SiO2和CaSiO3均为固体)
(1)求生成的CO2的体积(标准状况下)
(2)求原混合物中所含SiO2的质量。
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
把5.1 g镁铝合金的粉末放入过量的300 mL 2 mol·L-1盐酸中,得到5.6 L H2(标准状况下)。试计算:
(1)该合金中铝和镁的物质的量之比。
(2)在反应后的溶液中加入4 mol·L-1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
浓硫酸具有强氧化性可将红磷氧化为磷酸,其反应原理是
2P+5H2SO4(浓)==2H3PO4+5SO2↑+2H2O
若有1.24g的红磷参加反应,则:
(1)标出该反应的电子转移方向及数目。
(2)计算生成的SO2在标准状况下的体积。(写出计算过程)
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
请回答下列问题:
(1)求参加反应的二氧化锰的质量。
(2)求反应中被氧化的HCl的物质的量。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,求该浓盐酸中HCl的物质的量浓度。
常温下,要将质量分数为10%的氯化钠溶液100g变为质量分数为20%的氯化钠,常用的方法有加入溶质和蒸发溶剂。请通过计算回答:
⑴需要加入氯化钠晶体 g。
⑵需要蒸发掉 g水。
把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为
4.6mol/L(溶液体积变化忽略不计).
求:
(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
由某气态烃和气态单烯烃组成的混合物, 22.5,取在标准状况下的此混合气体4.48L,通入溴水中,结果溴水增重2.1g,通过计算回答:
(1)混合气由哪两种烃组 成;
成;
(2)它们的体积百分比各是多少?
(3)写出该烃发生聚合反应的化学方程式。