400 mL NaNO3和AgNO3的混合溶液中c(NO3—)=4 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),假设电解后溶液体积仍为400 mL。试计算:
(1)上述电解过程中转移电子的物质的量;
(2)电解后溶液中的c(H+)。
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况)。请回答下列问题:
(1)B元素在元素周期表中的位置是 。
(2)A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序是(写化学式)
。
(3)A、B两元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式
。
(4)将B单质与石墨按如右图装置连接,石墨电极的名称为 ;该电极反应式为: 。
(5)C的一种氧化物是常见的大气污染物。为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO4·2H2O)。假设在转化过程中C元素不损失,每天处理1120 m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上可以得到多少千克石膏(请写出简要的计算过程)。
恒温下,将a mol N2和b mol H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.92倍,试求:
(1)反应前混合气体中N2和H2的体积比a﹕b=__________;
(2)达到平衡时混合气体中的H2、NH3的物质的量分别是_____mol、 mol;
(本小题请给推算过程)
(3)平衡时N2的转化率[n转化(N2)与n初始(N2)之比]________________。
(6分)室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复到至室温,气体体积减少了50 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL 。求气态烃的分子式并写出该分子式的所有同分异构体。
在盛有500mL 0.4mol/LH2SO4混合溶液的大烧杯中。用锌、铜作电极,用导线连接形成原电池,当电极锌消耗6.5g时,试完成:
(1)写出电极反应式:负极_______________;正极_____________________。
(2)电极上共析出氢气的质量。
已知某金属晶体是面心立方堆积,金属原子的半径为a pm,摩尔质量为Mg/mol,阿伏加德罗常数为NA
求(1)该晶胞中含有原子的个数?
(2)该金属的密度(用a、M、NA来表示)
(3)空间利用率为多少?
在25℃下,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合后,溶液中c(NH4+)=c(Cl-)。试用含a的代数式计算NH3·H2O的电离常数Kb。
晶胞是晶体结构中的基本重复单元。利用X-射线衍射法发现金(Au)晶体的晶胞具有面心立方结构(即,晶胞中Au原子的中心处在立方体的各个顶点上和每个面的中心位置上)。晶胞的边长为0.408nm。
(a)画出金的晶胞并计算该晶胞中含有多少个金原子。
(b)Au的密度为1.93×104kg·m-3。计算该立方晶胞的体积和质量。
(c)已知Au的相对原子质量为196.97,由此计算1个Au原子的质量和阿伏伽德罗常量。
在一定温度下的密闭容器中存在如下反应:2SO2(g)+ O2 (g) 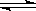 2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程)
2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程)
(1)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类分别为m、n。如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为____________;当B在A的下一周期时,B的原子序数为____________。如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为______________;当B在A的下一周 期时,B的原子序数
期时,B的原子序数 为_____________。
为_____________。
(2) A、B两元素同周期,A位于ⅡA族,B位于ⅢA族,A的原子序数为x,B的原子序数为y,则y-x=_________或_________或_________。
(共6分)在101.3k Pa、476K条件下,十一烷以及分子中碳原子数比它小的烷烃均为气态。以下变化中,最初与最终均维持这种条件。A、B、C三种烷烃(气)分子中碳原子依次增加相同的个数,取等体积的三种气体,分别跟30mL O2(过量)混合引燃,充分反应后发现:A与O2反应前后气体总体积不变;B与O2反应后气体总体积增加了4mL;C与O2反应后气体总体积为反应前的1.25倍。试求:
(1)A的分子式。
(2)原任意一种烷烃的体积及B的分子式。
已知硅与强碱氢氧化钠溶液反应的化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑。现将11.5g钠和4.2g硅同时投入100g水中。
(1)钠与水反应的化学方程式为 ;
(2)在标况下共收集到H2 升;(提示:与Si反应的NaOH是过量的)
(3)若所得溶液的体积为100mL,则Na2SiO3溶液的物质的量浓度为 mol·L-1。
将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(1)写出OA段所发生反应的离子方程式: ;
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况);
(3)原混合物中Na2CO3的质量分数为 。
用Cu与浓硫酸反应,得到SO2的体积为4.48L(标准状况)。请计算:
(1)被还原的硫酸的物质的量。
(2)将得到的溶液稀释到50mL,求溶液中CuSO4的物质的量浓度。