A、B、C三种有机物均由碳、氢、氧三种元素组成,物质A能溶于水,它的式量是60,分子中有8个原子,其中氧原子数与碳原子数相等,A能与Na2CO3反应。B分子中有9个原子,分子内原子的核电荷数之和为26,1 mol B 充分燃烧时需消耗3 mol O2。C是B的同系物,其摩尔质量与O2相同,C可与钠反应生H2。问A、B、C各是什么物质?(要求写步骤)
在一密闭容器中,用等物质的量的A和B发生如下反应:
A(g)+2B(g)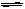 2C(g)
2C(g)
反应达到平衡时,若混和气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为多少?
某种烃折合成标准状况下的密度为3.215g/L,该烃分子中碳的质量分数为83.3%。
(1)求该烃的相对分子式
(2)确定烃的分子式 (1、2小问必需写出计算过程)
(3)写出该烃可能有的结构简式
(4)若该烃的一氯代物只有一种,写出该烃的名称。
有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.32g。求:
(1)金属M的相对原子质量及x、y值。
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)。
(12分)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)原子序数为22基态钛原子的核外电子排布式为 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 。
(4分 )(1)化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH=" 436" kJ·mol-1],形成 化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH =" -185" kJ·mol-1
ΔH298(H2)=" 436" kJ·mol-1 ,ΔH298(Cl2)=" 247" kJ·mol-1
则ΔH298(HCl)=" ________________________" 。
(2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH =" -25" kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH =" -" 47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH =" 19" kJ·mol-1
请写出CO还原FeO的热化学方程式:________________________________________
某抗酸药每片含碳酸钙534mg、氢氧化镁180mg。试计算10片该药片理论上可中和1.00mol·L-1的盐酸溶液多少毫升恰好反应?
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
把5.1 g镁铝合金的粉末放入过量的300 mL 2 mol·L-1盐酸中,得到5.6 L H2(标准状况下)。试计算:
(1)该合金中铝和镁的物质的量之比。
(2)在反应后的溶液中加入4 mol·L-1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
浓硫酸具有强氧化性可将红磷氧化为磷酸,其反应原理是
2P+5H2SO4(浓)==2H3PO4+5SO2↑+2H2O
若有1.24g的红磷参加反应,则:
(1)标出该反应的电子转移方向及数目。
(2)计算生成的SO2在标准状况下的体积。(写出计算过程)
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
请回答下列问题:
(1)求参加反应的二氧化锰的质量。
(2)求反应中被氧化的HCl的物质的量。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,求该浓盐酸中HCl的物质的量浓度。
常温下,要将质量分数为10%的氯化钠溶液100g变为质量分数为20%的氯化钠,常用的方法有加入溶质和蒸发溶剂。请通过计算回答:
⑴需要加入氯化钠晶体 g。
⑵需要蒸发掉 g水。
把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为
4.6mol/L(溶液体积变化忽略不计).
求:
(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
由某气态烃和气态单烯烃组成的混合物, 22.5,取在标准状况下的此混合气体4.48L,通入溴水中,结果溴水增重2.1g,通过计算回答:
(1)混合气由哪两种烃组 成;
成;
(2)它们的体积百分比各是多少?
(3)写出该烃发生聚合反应的化学方程式。