浙江省东阳市南马高中高二下学期第一次月考化学试题
一定温度下,可逆反应A2(g)+3B2(g) 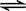 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时生成3mol B2 |
| C.单位时间内反应物减少的分子数等于生成物增加的分子数 |
| D.容器内A2、B2、AB3的物质的量浓度之比为1:1:1 |
在由水电离产生的c(H+)=1×10-14mol/L的溶液中,一定可以大量共存的离子组是
A.K+、A l3+、Br-、SO42- l3+、Br-、SO42- |
B.Na+、Mg2+、Cl-、NO3- |
| C.K+、Ba2+、Cl-、NO3- | D.K+、Na+、SO32-、SO42- |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2 + Pb + 2H2SO4 = 2PbSO4↓ + 2H2O,根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 | B.负极的电极反应式为:Pb + SO – 2e – = PbSO4↓ – 2e – = PbSO4↓ |
| C.PbO2得电子,被氧化 | D.电池放电时,溶液酸性增强 |
下列说法正确的是
| A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 |
| B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+ 与Cl-浓度的乘积等于1.8×10-10 mol2·L-2 |
| C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
下列叙述正确的是
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2mol/L的盐酸,与等体积水混合后pH=1 |
| D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
下列关于判断过程的方向的说法错误的是
| A.NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
| B.同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
C.不借助于外力能自发进行的过程,其体系的能量趋向 于从高能状态转变为低能状态 于从高能状态转变为低能状态 |
| D.由能量判据和熵判据组合而成的复合判据,更适合于所有的过程 |
酸式盐中NaHSO4、NaHSO3、NaH2PO4中酸根离子以电离为主,故显酸性而抑制水的电离,
其余均以水解为主而促进水的电离。已知某NaHSO3溶液的pH=4,则有关NaHSO3溶液
的说法中正确的是
| A.NaHSO3溶液中水的电离程度小于Na2SO3溶液,也小于Na2SO4溶液 |
| B.[H2SO3]>[HSO3-]>[SO32-] |
| C.该溶液中由水电离出的[H+]为1×10-4mol/L |
D.加入少量NaOH 使溶液的pH 使溶液的pH 升高会使水的电离受抑制 升高会使水的电离受抑制 |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂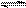 HIn(溶液) H+(溶液)+In-(溶液)
HIn(溶液) H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液①盐酸②石灰水③NaCl溶液 ④NaHSO4溶液
⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是
| A.①④⑤ | B.②⑤⑥ | C.①④ | D.②③⑥ |
将0.1mol/L的醋酸钠溶液20ml与0.1mol/L的盐酸10ml混合后,溶液显酸性,则溶液
中有关离 子的浓度关系正确的是
子的浓度关系正确的是
| A.c(CH3COO-)﹥c(Cl-)﹥c(CH3COOH)﹥c(H+) |
| B.c(CH3COO-)﹥c(Cl-)﹥c(H+)﹥c(CH3COOH) |
| C.c(CH3COO-)=c(Cl-)﹥c(H+)﹥c(CH3COOH) |
| D.c(Na+) + c(H+)=c(CH3COO-)+c(Cl-) |
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g)  n C(g)的反应体系
n C(g)的反应体系
中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是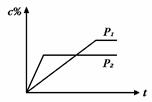
| A.P1>P2,n<3 | B.P1<P2,n>3 |
| C.P1>P2,n>3 | D.P1<P2,n<3 |
室温时,下列混合溶液的pH一定小于7的 是
是
| A.pH=3的盐酸和pH=11的氨水等体积混合 |
| B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
| C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
| A.Na2CO3 NaHCO3 NaCl NH4Cl | B.Na2CO3 NaHCO3NH4ClNaCl |
| C.(NH4)2SO4 NH4Cl NaNO3 Na2S | D.NH4Cl (NH4)2SO4 Na2S NaNO3 |
向三份0.1mol·L-1 CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略
溶液体积变化),则CH3COO- 浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)
2HBr(g)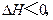 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡
时Br2(g)的转化率为b。a与b的关系是
| A.a>b | B.a="b" | C.a<b | D.无法确定 |
发射“神五”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生N2和水
蒸气。已知:N2(g) + 2O2(g) = 2NO2(g);△H =" +" 67.7kJ/mol。
N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H =" –" 534kJ/mol。
下列关于肼和NO2反应的热化学方程式中,正确的是
| A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H =" –" 1135.7kJ/mol |
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O( g);△H =" –" 1000.3kJ/mol g);△H =" –" 1000.3kJ/mol |
| C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H =" –" 1135.7kJ/mol |
| D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H =" –" 1135.7kJ/mol |
向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起
| A.溶液的pH增大 | B.CH3COOH的电离程度增大 |
| C.溶液的导电能力减小 | D.溶液的c (OH – )减小[来 |
下列化学反应的离子方程式正确的是
A.在稀氨水中通入过量CO2: NH3·H2O+CO2 = NH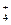 +HCO +HCO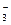 |
B.少量SO2通入Ca(ClO)2溶液中: SO2+H2O+Ca2++2ClO-=CaSO3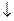 +2HclO +2HclO |
C.用稀HNO3溶液溶解FeS固体:FeS+2H+=Fe2++H2S |
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO =CaSO4 =CaSO4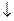 +H2O +H2O |
下列事实不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 |
| C.升高温度能够增大Na2CO3溶液的PH。 |
| D.工业上合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施。 |
下列操作中,能使电离平衡H2O H++OH-向右移动且溶液呈酸性的是
H++OH-向右移动且溶液呈酸性的是
| A.向水中加入NaHSO4溶液 | B.向水中加入Al2(SO4)3固体 |
| C.向水中加入Na2CO3溶液 | D.将水加热到100℃,使pH=6 |
实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值大于1,0.1mol/L某一元碱
(BOH)溶液里c(H+)/c(OH-)=10-12。将此两种溶液等体积混合后,所得溶液呈的各离
子的浓度由大到小排列的顺序是
A.c(B +)>c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
+)>c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=
1.0 mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物
的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
| A.若增大CO浓度,K2和K1都增大 | B.K2>K1 |
| C.c2(CO)=c2(H2O) | D.c1(CO)>c2(CO) |
下列说法中,正确的是
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大 |
B.AgCl悬浊液中存在平衡: AgCl(s)  Ag+(aq)+Cl―(aq),往其中加入少量 Ag+(aq)+Cl―(aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
| C.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl) > Ksp(AgI) |
| D.硬水含有较多Ca2+、Mg2+、HCO3―、SO42―,加热煮沸可以完全除去其中的Ca2+、Mg2+ |
(1)AgNO3的水溶液常温时的pH___7(填“>”、“=”、“<”),原因是(用离子方程式表示):___________________________。实验室在配制AgNO3的溶 液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____________________其水解。
液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____________________其水解。
(2)氯化铝水溶液_______性,原因是(用离子方程式表示)_________________________________ 。
把AlCl3溶液蒸干灼烧最后得到的主要固体产物是_______________________________。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的_________________。
依据氧 化还原反应:2Ag+(aq) + Cu(s) ="=" Cu2+(aq) + 2Ag(s)设计的原电池
化还原反应:2Ag+(aq) + Cu(s) ="=" Cu2+(aq) + 2Ag(s)设计的原电池
如图所示。请回答 下列问题:
下列问题: (1)电极X的材料是________;电解质溶液Y
(1)电极X的材料是________;电解质溶液Y
是_________;
(2)银电极为电池的___________极,发生的
电极反应为______________;X电极上发
生的电极反应_____________________;
(3)外电路中的电子是从__________电极流向
_____________电极。
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如
下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶
液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入
250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达
终点时溶液由______色变为_______色,且半分钟不褪色。 (提示:指示剂变色
(提示:指示剂变色
范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1~2滴指示剂;②向
锥形瓶中加20mL~30mL蒸馏水溶解;③用NaOH溶液滴定到终点,半分钟不褪
色;④重复以上操作;⑤准确称量0.4000g ~ 0.6000g邻 苯二甲酸氢钾加入
苯二甲酸氢钾加入
250mL锥形瓶中;⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?
_____________。(填“有影响”或 “无影响”)
“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使
实验结果____________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶[
于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为
20.00mL,则NaOH溶液的物质的量浓度 为________。(结果保留四位有效数字)
为________。(结果保留四位有效数字)
无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、
Cl- 、OH-、HCO3-、NO3-。已知该溶液能跟金属铝反应,且放出的气体只有氢气。
试回答:
(1)若溶液和铝反应后有AlO2-生成,则其中一定含有大量的__________离子,
还可能含有大量的_________________离子。
(2)若溶液和铝反应有Al3+生成,则原溶液中一定不含有大量的__________离子。
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后
溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表 示);
示);
(2)混合溶液中由水电离出的c(H+)_____0.1 mol·L-1 NaOH溶液中由水电离出
的c(H+);(填>、<、=)
(3)求出混合液中下列 算式的精确计算结果(填具体数字):
算式的精确计算结果(填具体数字):
c (Na+)-c (A-)="________" mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断
(NH4)2CO3溶液的pH _______7 (填>、<、=);
水在25℃和95℃时,其电离平衡曲线如
右图所示:
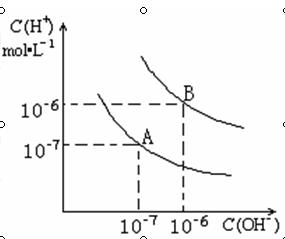
(1)则25 时水的电离平衡曲线应为_____________。
(2)25时,将=9的NaOH溶液与=4的溶液
混合,若所得混合溶液的=7,则NaOH溶液与
溶液的体积比为____________。
(3)95时,若100体积 1=的某强酸溶液与1体积
2= b的某强碱溶液混合后溶液呈中性,则混合前,
与 b之间应满足的关系是______________。
 2SO3(g)在一定条件下达到平衡,测得c(SO2)=0.040mol·L-1。
2SO3(g)在一定条件下达到平衡,测得c(SO2)=0.040mol·L-1。 粤公网安备 44130202000953号
粤公网安备 44130202000953号