(9分)一定温度下有反应2NO2(g)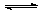 2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
(1)用NO浓度表示的平均化学反应速率;
(2)NO2的分解率;
(3)该反应的平衡常数。
(9分)一定温度下有反应2NO2(g)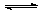 2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
(1)用NO浓度表示的平均化学反应速率;
(2)NO2的分解率;
(3)该反应的平衡常数。