下列四个装置图均与电化学有关,请根据图示回答相关问题:
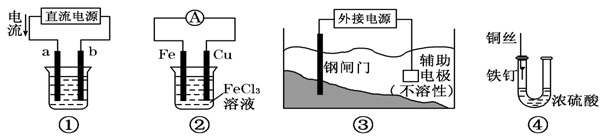
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
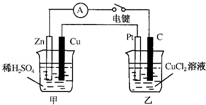
(1)甲装置的名称是 ;乙装置的名称是 ;Zn为 极;Pt为 极.
(2)写出电极反应式:Cu极 ;C极 .
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色 (填“变深”、“变浅”或“无变化”).
(4)若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将 (填“增大”、“减小”或“不变”,下同);乙中溶液的pH将 .
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图

假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
在25 ℃时,用石墨电极电解2.0 L 0.5mol·L-1 CuSO4溶液。5min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题。
(1)发生氧化反应的是__________极,电极反应式为____________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为____________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的_______。
铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。回答下列问题:(1)铅是碳的同族元素,比碳多4个电子层,铅在周期表的位置为 ① 周期,第② 族:PbO2的酸性比CO2的酸性 ③ (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 ④ 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ⑤ ;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式
⑥ ,阴极观察到的现象是 ⑦ ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式 ⑧ ,这样做的主要缺点是 ⑨ 。
SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中生成HSO3-的离子方程式为 ;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: ;
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3−、NO2−,写出生成NO3−的离子方程式_____ 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

①生成Ce4+的电极反应式为_____ 。
②生成Ce4+从电解槽的__________(填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2−的浓度为a g⋅L−1,要使1m3该溶液中的NO2−完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___ L。(用含a代数式表示,计算结果保留整数)
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用。
(1)Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,结构如图所示。电池工作时,正极的电极反应式 。常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);当消耗24mg金属Mg,电解后溶液的pH= (不考虑溶液的体积变化)。

(2)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是 。
a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液
b.电镀过程中,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
如图,外接电源为Zn-MnO2干电池,甲、乙为相互串联的两个电解池,请回答:

(1)甲池若为用电解原理精炼铜的装置,
B电极是 极,材料 A电极反应式为 ,
电解质溶液可以是
(2)乙池中Fe极是 极,若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色,若C电极
材料为石墨,C电极反应式为
(3)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。该电池的负极材料是 ,电极反应式为 。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极。

(1)接通电源,经过一段时间后,测得e电极上收集到气体在标准状况下体积为4.48L,乙中c电极质量增加。据此回答问题:
①电源的N端为 极。
②电极b上发生的电极反应为
③电解前后甲溶液 pH ;乙溶液 pH ;丙溶液 pH 。(填“变大”、“ 变小”或“不变”)
(2)写出乙溶液中的电解反应方程式: 需加入 g (填物质名称)复原。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a:X、Y是两块电极板,通过导线与直流电源相连。请回答下列问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______________,在X极附近观察到的现象是_____________。
②Y电极上的电极反应式为_______________,检测该电极反应产物的方法是_______________;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是______,电极反应式是_______________;
②Y电极的材料是______,电极反应式是_______________;(说明:杂质发生的电极反应不必写出)
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按下图连接。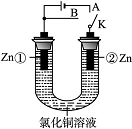
(1)如果把电键K接A,该装置应是________,Zn①为________极,Zn②的电极反应为________________。
(2)上述反应进行5 min后,转换电键K到B,则这一装置是________,Zn②为________极,Zn①的电极反应式是____________________。
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,K接A,此时该装置为______池,阴极电极反应式为____________________________。
【化学——选修2:化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到10000C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是 , 反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 ; ;

(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右。
资料:氰化钠化学式为NaCN,白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味。剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性,是一种重要的化工原料, 用于电镀、冶金和有机合成医药、农药及金属处理方面。
(1)氰化钠要用双氧水或硫代硫酸钠中和。①用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式 ;
②用硫代硫酸钠中和的离子方程式为CN-+S2O32-=A+SO32-,A为 (填化学式)。

(2)含氰废水中的CN-有剧毒。
①用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,
则:①阳极电极方程式为:
②去除CN-的离子方程式为:
(3)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,也可用于含氰废水的消毒。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:

已知:2Na2CO3(aq)+ 3H2O2(aq) 2Na2CO3·3H2O2(s)ΔH < 0,请回答下列问题:
2Na2CO3·3H2O2(s)ΔH < 0,请回答下列问题:
①下列物质中,不会引起过碳酸钠发生氧化还原反应的有 。
| A.FeCl3 | B.CuSO4 | C.Na2SiO3 | D.KCN |
②准确称取0.2000g过碳酸钠于250mL锥形瓶中,加50 mL蒸馏水溶解,再加50 mL2.0 mol·L-1 H2SO4,用0.02000mol·L-1 KMnO4标准溶液滴定,是否需要指示剂 (填“是”或“否”),若终点时消耗KMnO4标准溶液30.00 mL,则产品中H2O2的质量分数为 。
[反应6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4 = 3K2SO4 + 6MnSO4 +10Na2SO4 +10CO2 ↑ +15O2↑+34H2O]
2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含以下种类物质:压缩气体天然气、易燃液体甲醇、乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等。
(1)由于CaC2、金属钠、金属钾以及固体NaH等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。(填序号)其中固体NaH与水反应的方程式为
A.泡沫灭火器 B.消防车喷水 c.沙土
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤。①其水溶液呈强碱性,故俗称硫化碱。 ②其水溶液在空气中会缓慢地氧化成Na2S2O3,该反应中还原剂与氧化剂物质的量之比为 。
(3)以上易燃液体甲醇是一种可再生能源,具有开发 和应用的广阔前景,如:

①2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图1所示.
该电池正极的电极反应式为 ;负极的电极反应式 ;工作一段时间后,当6.4g甲醇完全反应生成CO2时,有 个电子发生转移.
②以上述电池做电源,用图2所示装置模拟氯碱工业,若只有铝棒和碳棒两个电极,则与电源负极相连的是 (铝棒或碳棒),写出电解该溶液总反应方程式
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。