SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中生成HSO3-的离子方程式为 ;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: ;
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3−、NO2−,写出生成NO3−的离子方程式_____ 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

①生成Ce4+的电极反应式为_____ 。
②生成Ce4+从电解槽的__________(填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2−的浓度为a g⋅L−1,要使1m3该溶液中的NO2−完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___ L。(用含a代数式表示,计算结果保留整数)
 ⑦
⑦ 和
和 ;⑧和
;⑧和
 用于估算化学反应的反应热(△H),化学反应的△H等于反应
用于估算化学反应的反应热(△H),化学反应的△H等于反应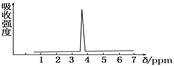
 粤公网安备 44130202000953号
粤公网安备 44130202000953号