观察下列装置,回答下列问题:
(1)装置B中PbO2上发生的电极反应方程式为 。
(2)装置A中总反应的离子方程式为 。
(3)若装置E中的目的是在Cu材料上镀银,则X为 ,极板N的材料为 。
极板M处的电极反应式为__________________。
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为 L(标准状况下,不考虑气体的溶解)。
(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲装置的名称是_____(填“原电池”或“电解池”)。
(2)写出电极反应式:Pt极 ;
当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色_______(填“变深”、“变浅”或“无变化”)。
(4)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为 。(用NA表示)
(Ⅱ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铁电极、铜电极、铂电极进行电解实验。
(1)欲使铁制品表面镀铜,应以_______为阳极,电解质溶液为 。
(2)以铂作阳极电解 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解时总反应的化学方程式为 。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。(说明:杂质发生的电极反应不必写出)
电解一段时间后,CuSO4溶液的浓度将 (填“变大”、“变小”或“不变”)
(10分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为_____(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为______。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是________(填字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
用惰性电极电解饱和NaCl溶液,请写出:
(1)阳极电极反应式: ;总反应式: 。
(2)要使电解后的溶液恢复到和原溶液一样,则应加入一定量的 。
(3)已知298K时下述反应的有关数据:C(s)+1/2 O2(g)=CO(g) △H1 = -110.5kJ/mol,C(s)+O2 (g)=CO2(g), △H 2= -393.5kJ/mol ,则C(s)+CO2(g)="2CO(g)" 的△H为
(8分)84消毒液是一种以次氯酸钠为主要成分的高效消毒剂。
(1)次氯酸钠溶液呈碱性,原因可用离子方程式表示为 ;
(2)二氧化碳、氢氧化钠、氯化钠三种物质中,添加到84消毒液中可增强其消毒效果的是 ;
(3)84消毒液可以通过电解氯化钠稀溶液制取,电解装置通常选用铁和碳棒为电极,电解时铁电极反应式为 。
如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失)。
请回答下列问题:
(1)分别指出F电极、②电极的名称 、 。
(2)④电极的反应式: 。
E电极的反应式: 。
(3)若A池中原混合液的体积为500 mL,CuSO4、K2SO4浓度均为0.1 mol/L,电解过程中A池中共收集到标准状况下的气体 L,①、③电极析出固体物质的量之比 。
在下图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极。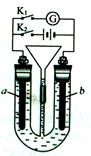
(1)断开K2接通K1时,a为_________极,b电极上的电极反应式为___________________
(2)断开K1接通K2时,a为__________极,该电极上的电极反应式为____________________,一段时间后,溶液的pH_________________(填“增大”,“减小”或“不变”)
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+6H2(g)+O2(g)==2CH3OCH3 (g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
______(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将
________(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将__________;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为____________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:
请写出电解过程中Y电极附近观察到的现象 ;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
(共16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为__________________(填化学式);滤液中滴加盐酸调PH=4-5的目的是
②选用75%乙醇洗涤除去NaCl晶体表面附带的少量 KCl,检验NaCl是否洗净的方法是
(2)用提纯的NaCl配制480mL 0.40 mol·L-1NaCl溶液,需要称取NaCl的质量为 g,所用仪器除药匙、玻璃棒、烧杯外还有_____________(填仪器名称);
(3)电解饱和食盐水的装置如图所示,
若收集的H2为2L,则同样条件下收集的Cl2 _____(填“>”、“=”或“<”)2L, 写出电解饱和食盐水的离子方程式
按下图所示装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为 ,B池为 ;
(2)锌极为 极,铜极上的电极反应式为 ,
石墨棒C1为 极,电极反应式为 ,
石墨棒C2附近产生的现象为 ;
(3)当C2极析出气体224mL(标准状况),锌的质量变化为 g(“增加”或“减少”)。
下图是一个化学过程的示意图
回答下列问题:(1)甲池是 装置,电极A的名称是 。
(2)甲装置中通入CH4的电极反应为
乙装置中B(Ag)的电极反应式为 ,
丙装置中D极的产物是 (写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH =_______ 。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。
若要使丙池恢复电解前的状态,应向丙池中通入 (写化学式)。
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图: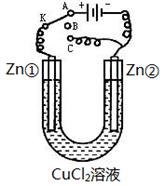
(1)如果把电键K接A,这一装置形成______装置,Zn①极是____极,其电极反应式是 ;Zn②极上的电极反应式是 。
(2)上述反应进行5min后,转换电键K到C,这一装置形成_____装置,Zn①极是____极,该装置发生反应的总化学方程式是 。
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于_____,被腐蚀的金属是____,Zn①极发生的腐蚀主要属于______。
(22分)如下图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于原电池的是_____________。
(2)A池中Zn是_____________极, Cu极发生_____________反应,电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
(3)B池中C棒发生_________反应,电极反应为_________。B 池中的总反应为_ __。
(4)C池中Zn极的反应现象为 _____________。Cu极电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。