(12分)如图装置闭合电键时,电流计A的指针将发生偏转。试回答下列问题。
(1)A池是____________;Zn的电极名称是____________;B池是____________;
Pt的电极名称是____________(填电解池、原电池、阴、阳、正、负极等)
(2)写出下列有关反应:C极上电极反应:_________________
(3)B池中的总反应的化学方程式为________________________
按下图装置进行实验,并回答下列问题。
(1)判断装置的名称:A池为___________B池为______________
(2)锌极电极反应式为_________________________
石墨棒C1电极反应式为________________________
石墨棒C2附近发生的实验现象为______________________________
(3)当C2极析出224mL气体(标准状况)时,CuSO4溶液的质量增加_________g。
(9分) 观察下列几个装置示意图,有关叙述正确的是
(1)在①图中,发生反应的化学方程式为: 。
(2)在②图中,待镀铁制品应与电源 极相连,电极反应式为: 。
(3)在③图中,外电路电子由 极流向 极,若电解液为KOH溶液,则b极的反应式为 。
如图为相互串联的甲、乙两电解池。
试回答:
(1)若甲电解池利用电解原理在铁上镀银,则A是 (填电极材料),B是 (填电极材料),应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____色。乙电解池的电解方程式为 。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是 mL。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于 。
下图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH === 2K2CO3+6H2O
请回答:
(1)甲池是__________(填“原电池”或“电解池”),通入CH3OH的电极作为_____极,通入O2的电极作为_____极,该电极反应式为_________________________________。
(2)乙池是__________(填“原电池”或“电解池”),A电极名称为_____极,电极反应式为_________________________________。
(3)甲池中溶液的pH_____ (填“增大”、“减小”或“不变”);乙池中溶液的pH_____(填“增大”、“减小”或“不变”)。
(4)当乙池中B(Ag)极的质量增加5.40 g时,电路中转移电子的物质的量是_____mol,甲池中理论上消耗O2_____mL(标准状况下)。
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏(CaSO4·2H2O)可以降低土壤的碱性。试用化学方程式表示用石膏降低土壤碱性的反应原理________。
(2)习惯上把电解饱和食盐水的工业生产叫做氯碱工业,用化学方程式表示电解饱和食盐水的总反应为________________________。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是_____________。(填写化学式,只填一种即可)
(4)通过火法冶金炼出的铜是粗铜,不适于电器及其他许多工业使用,必须进行电解精炼。电解时,用________作阴极,________作阳极。
如下图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
(1)A极是电源的 ,甲装置观察到的现象是 、 、 。
(2)C极的电极反应式为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是
溶液。
(8分)如图中是电解氯化钠溶液(含酚酞)的装置。有毒气体收集的装置省略没有画出,两电极均是惰性电极。
(1)a电极的名称___________________________________________。
(2)电解过程中观察到的现象_________________________________。
(3)确定N出口的气体最简单的方法是_________________________
(4)电解的总反应离子方程式为___________________________________。
(5)若将b电极换成铁作电极,写出在电解过程中U形管底部出现的现象________________________。
(每空2分,共14分)电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: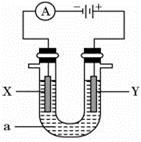
(1)若X、Y都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①Y电极上的电极反应式为____________________,该电极产生的现象是 。
②该反应的总反应化学方程式是: ______________________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是__________,电极反应式是____________________。
(3)若用惰性电极电解500 mL CuSO4溶液,溶液中 Cu2+ 完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极质量增加1.6 g。
①要使电解后溶液恢复到电解前的状态,需加入一定量的________(填加入物质的化学式)。(假设电解前后溶液的体积不变)
②溶液的pH= 。
(9分)电化学原理在医学医疗中有重要应用。
(1)碘可用作心脏起搏器电源—锂碘电池的材料。该电池反应如下:2Li(s)+I2(s) 2LiI(s) △H
2LiI(s) △H
已知:4Li(s)+O2(s) 2Li2O(s) △H1 4LiI(s)+O2(s)
2Li2O(s) △H1 4LiI(s)+O2(s) I2(s)+2Li2O(s) △H2,
I2(s)+2Li2O(s) △H2,
则△H=_____________________;碘电极作为该电池的_______极。
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],其原理如图所示。
请回答下列问题:
①直流电源的负极为___________(填“A”或“B”);
②阳极室中发生的反应依次为______________________、_______________________;
③电解结束后,阴极室溶液的pH与电解前相比将_____________(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___________g(忽略气体的溶解)。
(9分)电化学原理在医学医疗中有重要应用。
(1)碘可用作心脏起搏器电源—锂碘电池的材料。该电池反应如下:
已知:2Li(s)+I2(s)=2LiI(s)△H
4Li(s)+O2(g)=2Li2O(s)△H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则△H=______________;碘电极作为该电池的_______极。
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],其原理如图所示。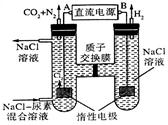
请回答下列问题:
①直流电源的负极为___________(填“A”或“B”);
②阳极室中发生的反应依次为______________________、_______________________;
③电解结束后,阴极室溶液的pH与电解前相比将_____________(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___________g(忽略气体的溶解)。
(13分)天然气的主要成分是甲烷,它是一种重要的燃料和基础化工原料。
(1)以甲烷和水为原料可制取甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ/mol
CO(g)+3H2(g) △H=+206.0kJ/mol
②CO(g)+2H2(g) CH3OH(g) △H=—129.0kJ/mol
CH3OH(g) △H=—129.0kJ/mol
则CH4(g)+H2O(g) CH3OH(g)+H2(g)的△H=__________kJ/mol。
CH3OH(g)+H2(g)的△H=__________kJ/mol。
(2)用甲烷催化还原NOx为N2可消除氮氧化物的污染,写出反应的化学方程式_______。
(3)一定条件下,反应CH4(g)+H2O(g) CO(g)+3H2(g)可以制取合成氨的原料气H2。将1.0mol CH4和2.0 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度的关系如图。已知100℃时达到平衡所需的时间是5min,则用H2表示的反应速率v(H2)=___________;该温度时的平衡常数K=__________,该反应的△H_______0(填“<”、“>”或“=”)。
CO(g)+3H2(g)可以制取合成氨的原料气H2。将1.0mol CH4和2.0 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度的关系如图。已知100℃时达到平衡所需的时间是5min,则用H2表示的反应速率v(H2)=___________;该温度时的平衡常数K=__________,该反应的△H_______0(填“<”、“>”或“=”)。
(4)某化学小组设计如图装置进行饱和NaCl溶液电解实验。
请回答下列问题:
已知每个甲烷燃料电池中盛有1.0L2.0 mol/L的KOH溶液。标准状况下,当每个燃料电池的负极通入甲烷的体积均为33.6L,且反应完全,则理论上电池溶液中c(K2CO3)_______c(KHCO3)(填“<”、“>”或“=”):最多能产生标准状况氯气的体积为________L。
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓 慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
(10分)Ⅰ、在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
①A中反应的离子方程式为:_______________________________。
②B中Sn极附近溶液的pH________(填“增大”、“减小”或“不变”)。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
Ⅱ、如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的________棒。
②乙池中阳极的电极反应式是___________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①甲池中碳棒上电极反应式是_____________________,
②乙池电解一段时间后,测知溶液体积为200ml,PH=13,则阴极生成的气体在标准状况下体积是______L。
铁及其化合物与生产、生活关系密切。
Ⅰ.为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与蓄电池这样的直流电源的 极(填“正”或“负”)相连。
II.为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
(2)实验过程中,SO42− (填“从左向右”“从右向左”或“不”)移动
(3)滤纸上发生的化学方程式为: 。
III.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(4)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和 。
(6)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。