湖南省怀化市中小学课改高二上学期期末化学试卷
今有如下三个热化学方程式:
H2(g)+1/2O2(g) = H2O(g) ΔH=a kJ·mol-1
H2(g)+1/2O2(g) = H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g) = 2H2O(l) ΔH=c kJ·mol-1
关于它们的下列表述,正确的是
| A.它们都是吸热反应 | B.氢气的燃烧热为ΔH=a kJ·mol-1 |
| C.反应热的关系:a=b | D.反应热的关系:2b=c |
对于可逆反应A(g)+3B(g) 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1 B.v(C)=1.6 mol·L-1·min-1
C.v(D)=0.4 mol·L-1·min-1 D.v(B)=1.8 mol·L-1·min-1
在CH3COOH溶液中存在如下平衡:CH3COOH H++CH3COO-。加入少量下列固体物质,能使平衡逆向移动的是
H++CH3COO-。加入少量下列固体物质,能使平衡逆向移动的是
| A.CH3COONa | B.NaCl | C.Na2CO3 | D.NaOH |
银锌电池广泛用作电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O=2Ag+Zn(OH) 2,则负极上发生反应的物质是
| A.Ag | B.Zn(OH)2 | C.Ag2O | D.Zn |
已知25 ℃、101 kPa条件下:3O2(g)=2O3(g) ΔH=+284.2 kJ·mol-1下列说法正确的是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量高,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Z为0.3 mol/L | B.Y2为0.1 mol/L |
| C.X2为0.2 mol/L | D.Z为0.4 mol/L |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 | B.水的离了积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 | D.水的离子积变大、pH变小、呈中性 |
在铁制品上镀上一定厚度的锌层,以下设计方案正确的是
| A.锌作阳极,镀件作阴极,溶液中含有锌离子 |
| B.铂作阴极,镀件作阳极,溶液中含有锌离子 |
| C.铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| D.锌用阴极,镀件作阳极,溶液中含有锌离子 |
下面提到的问题中,与盐的水解无关的是
| A.明矾和FeCl3可作净水剂 |
| B.为保存FeCl3溶液,要在溶液中加少量盐酸 |
| C.用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 |
| D.氢氟酸用塑料试剂瓶保存而不用玻璃试剂瓶保存 |
在恒容密闭容器中发生反应2NO2  2NO+O2,不能说明反应达到平衡状态的是
2NO+O2,不能说明反应达到平衡状态的是
| A.单位时间内生成n molO2的同时生成2n molNO2 |
| B.单位时间内生成n molO2的同时生成2n molNO |
| C.混合气体的颜色不再改变 |
| D.氧气的含量不再改变 |
0.1 mol/L NaOH和0.1 mol/L NH4Cl溶液等体积混和后,离子浓度大小顺序正确的是
| A.c(Na+)>c(Cl-)>c(OH-)>c(H+) | B.c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C.c(Na+)=c(Cl-)>c(H+)>c(OH-) | D.c(Cl-)>c(Na+)>c(OH-)>c(H+) |
根据金属活动性顺序表,Ag不能发生2Ag+2HCl = 2AgCl+H2↑的反应。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,能实现该反应最为恰当的是
| |
A |
B |
C |
D |
| 阳极 |
石墨棒 |
Ag |
Fe |
Ag |
| 阴极 |
石墨棒 |
石墨棒 |
Ag |
Pt |
| 电解液 |
CuCl2溶液 |
盐酸溶液 |
H2SO4溶液 |
H2O |
下列说法中,正确的是
| A.中和反应是放热反应,盐类水解反应是吸热反应 |
| B.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| C.在101 kPa时,1 mol碳燃烧所放出的热量一定叫碳的燃烧热 |
| D.CO燃烧是吸热反应 |
100 ℃时,水的离子积为1×10-12,若该温度下某溶液中的H+浓度为1×10-7 mol·L-1,则该溶液呈
| A.酸性 | B.碱性 | C.中性 | D.无法判断 |
密闭容器中进行下列反应:M(g)+N(g) R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是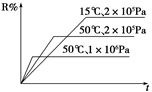
| A.正反应吸热,L为气体 |
| B.正反应吸热,L为固体或纯液体 |
| C.正反应放热,L为气体 |
| D.正反应放热,L为固体或纯液体 |
串联电路中四个电解池分别装有0. 5 mol/L的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最小的是
| A.KNO3溶液 | B.NaCl溶液 | C.AgNO3溶液 | D.CuCl2溶液 |
在恒温恒压、不做功时,反应A+B=C+D在下列哪种情况下,一定能自发进行
| A.△H<0、△S<0 | B.△H>0、△S<0 |
| C.△H<0、△S>0 | D.△H>0、△S>0 |
已知在25 ℃时:2C(s)+O2(g)=2CO(g) △H1=-222 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394 kJ/mol
则25 ℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热 △H4为
| A.-82 kJ/mol | B.-41 kJ/mol |
| C.-312 kJ/mol | D.+82 kJ/mol |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI>Ag2CrO4 | B.AgCl>Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
一真空定容的密闭容器中盛有1 mol PCl5,发生反应PCl5(g)  PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入2 mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是
PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入2 mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是
| A.M>N | B.M=N | C.M<N | D.无法比较 |
用惰性电极电解一定量的硫酸铜溶液,当转移0.4 mol电子时,阴极开始产生气体,继续电解又转移0.2 mol电子时停止电解。下列说法正确的是
| A.电解过程中,溶液的pH不断增大 |
| B.当转移0.4 mol 电子时,电解生成的铜为12.8 g |
| C.阴极反应式为2H2O+4e-=4H++O2↑ |
| D.整个过程中产生的H2与O2的体积比为2:1 |
(每空2分,共16分)
Ⅰ、中学化学实验中的中和热的测定实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶液各50 mL。NaOH的浓度大于HCl的浓度作用是___________。在大小烧杯之间填满碎泡沫(或纸条)其目的是: 。
Ⅱ、某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_____________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______________________________为止。
(2)若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度 。(填“无影响”、“偏高”或“偏低”)。
Ⅲ、用实验确定某酸HA是弱酸。两同学的方案是:
甲:①配制0.1 mol·L-1的HA溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱酸。
乙:①配制0.1 mol·L-1的HA溶液100 mL;配制0.1 mol·L-1的盐酸溶液100 mL
②取相同体积的0.1 mol·L-1的HA和0.1 mol·L-1的盐酸溶液分别装入两只试管,同时加入表面积大小相同的锌粒,观察现象,即可证明HA是弱酸。
(1)在两个方案的第①步中,都要用到的定量仪器是____________________。
(2)甲方案中,说明HA是弱酸的理由是测得溶液的pH______ 1(选填“>”、“<”或“=”);乙方案中,说明HA是弱酸的现象是_______。
a.装HCl溶液的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两只试管中产生气体速率一样快
(每空2分,共14分)电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: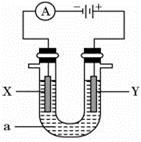
(1)若X、Y都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①Y电极上的电极反应式为____________________,该电极产生的现象是 。
②该反应的总反应化学方程式是: ______________________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是__________,电极反应式是____________________。
(3)若用惰性电极电解500 mL CuSO4溶液,溶液中 Cu2+ 完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极质量增加1.6 g。
①要使电解后溶液恢复到电解前的状态,需加入一定量的________(填加入物质的化学式)。(假设电解前后溶液的体积不变)
②溶液的pH= 。
(每空2分,共12分)
I、(1)已知1 g H2S气体完全燃烧,生成液态水和二氧化硫气体,放出17.24 kJ热量,请写出H2S气体燃烧热的热化学方程式:
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
II、已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32-) 且H2SO3的电离平衡常数为: K1=1.5×10-2 K2=1.1×10-7 ;氨水的电离平衡常数为K=1.8×10-2;
(1)则等物质的量浓度的下列五种溶液:①NH3·H2O ②KHSO3③KHCO3 溶液中水的电离程度由大到小排列顺序为
(2)0.1 mol·L-1的NaHSO3溶液中C(H+) C(OH-)(“>”、“<”或“=”):
Ⅲ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)在25 ℃下,向浓度均为0.1 mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol/L。此时所得沉淀中________(填“含有”或“不含有”)Al(OH)3。
(每空2分,共16分)
I、恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)该反应的平衡常数表达式为:K=
(2)若反应进行到某时刻t时,nt(N2)="8" mol,nt(NH3)="4" mol,计算 a= 。当反应达到平衡时,混合气体的体积为537.6 L(标况下),其中NH3的含量(体积分数)为25%。原混合气体中, a:b= 。
Ⅱ、反应mA+nB pC+qD在某温度下达到平衡。
pC+qD在某温度下达到平衡。
①若A、B、C 、D都是气体,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时C的物质的量浓度变为原来的1.6倍,则m、n、p、q的关系是m+n p+q(填“<”或“>”或“="”)" 。
②若A、B、C ,D都为气体,且m+ n = p+q,则将气体体积压缩后A的物质的量将 _________(填“减小”“增大”“不变”),平衡______移动。(填“正向”或“逆向”或“不”)
③若给体系升温,B的物质的量减少,则正反应为 ________反应(填“放热”或“吸热”)
④若在体系中增加A的量,平衡不发生移动,则A肯定不能为_____态。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号