河南省南阳市高二上学期期终质量评估化学试卷
某学生的实验报告所列出的下列数据中合理的是( )
| A.用1mol的醋酸溶液和1.01mol的氢氧化钠溶液做中和热实验测得中和热的数值为57.3kJ/mol |
| B.通过实验得知在常温常压下,12g固体C和32g气体O2所具有的总能量一定大于44g气体CO2所具有的总能量 |
| C.室温下,用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.7mL |
下列事实不能证明CH3COOH是弱电解质的是( )
①0.1mol/L的CH3COOH溶液的pH=2.1;②CH3COONa和盐酸反应,生成CH3COOH; ③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多;④常温下某CH3COONa溶液的pH=8;⑤用CH3COOH溶液做导电实验,灯泡很暗;⑥0.1mol/L的CH3COOH溶液稀释100倍,pH<3
| A.②⑤ | B.①②③ | C.⑤ | D.③④⑤⑥ |
下列各离子浓度的大小比较,正确的是( )
| A.0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B.0.01mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)> c(NH4+) > c(Na+) >c(OH-)>c(H+) |
| C.同浓度的下列溶液中:①(NH4)2SO4②NH4HCO3③NH4Cl,④NH3·H2O,c(NH4+)由大到小的顺序是:①>③>②>④ |
| D.常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) |
常温下,下列各溶液中,可能大量共存的离子组是
| A.pH=0的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.c(H+)=1×10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
| C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3- |
| D.由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、[Al(OH)4]-、S2-、CO32- |
下列事实,其中不能用平衡移动原理解释的是
| A.向0.1mol/L的CH3COOH溶液中加入少量CH3COONa固体,溶液pH增大 |
B.在密闭容器中充入一定量NO2建立2NO2(g)  N2O4(g)平衡后,增大压强,体系颜色加深 N2O4(g)平衡后,增大压强,体系颜色加深 |
| C.向水中投入金属Na,最终溶液呈碱性 |
| D.在滴有酚酞的Na2CO3溶液中,慢慢滴入BaCl2溶液,溶液的红色逐渐褪去 |
可逆反应:3A 3B+C △H>0,已知反应物A为气态物质,随着温度的升高,反应体系中气体的平均相对分子质量有变小趋势,则下列判断中,正确的是
3B+C △H>0,已知反应物A为气态物质,随着温度的升高,反应体系中气体的平均相对分子质量有变小趋势,则下列判断中,正确的是
①若C为固体,则B一定是气体 ②B和C一定都是气体
③B和C可能都是固体 ④B和C可能都是气体
| A.①② | B.②③ | C.①④ | D.③④ |
25℃时,已知:Ksp[MgF2]=7.42×10-11,Ksp[Mg(OH)2]=5.61×10-12。则该温度下,下列说法正确的是( )
| A.饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/LNH4Cl溶液中的Ksp小 |
| D.在Mg(OH)2悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化为MgF2 |
下列说法正确的是
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;②对于Al(OH)3(s)  Al(OH)3(aq)
Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡;③物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
Al3++3OH-,前者为溶解平衡,后者为电离平衡;③物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
| A.①②④⑤ | B.② | C.①③④⑤ | D.①②⑤ |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂: 
浓度为0.02mol/L的下列各溶液:①盐酸②石灰水③NaCl溶液④氨水⑤NaHCO3溶液⑥NaHSO4溶液 其中能使指示剂显红色的是
| A.①④⑤ | B.②⑤⑥ | C.③④ | D.①⑥ |
下列离子方程式正确的是
| A.向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-=I2+4Br-+2Fe3+ |
| B.向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg=4Cu+2Ag+5Mg2+ |
| C.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
| D.向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液: |
2HSO3-+4ClO-=2SO42-+2Cl-+2HClO
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )

| A.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| B.电池放电时Na+从b极区移向a极区 |
| C.每消耗3mol H2O2,转移的电子为3mol |
| D.该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
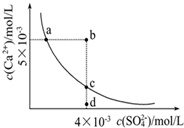
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
| A.2句 | B.3句 | C.4句 | D.5句 |
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)  xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是
xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是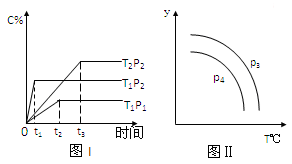
| A.若P3>P4,则y轴表示B的百分含量 |
| B.若P3>P4,则y轴表示混合气体的平均摩尔质量 |
| C.若P3<P4,则y轴表示B的体积分数 |
| D.若P3<P4,则y轴表示混合气体的密度 |
将含有0.4molNaCl和0.4molCu(NO3)2的水溶液1L用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另一个电极上放出气体的体积(标准状况)约为
| A.6.72L | B.5.6L | C.2.8L | D.13.44L |
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断下列说法正确的是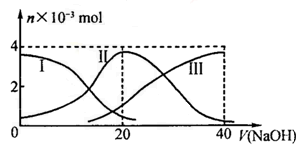
| A.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| B.向Na2A溶液加入水的过程中,pH可能增大也可能减小 |
| C.欲使NaHA溶液呈中性,可以向其中加入酸 |
| D.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是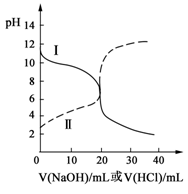
| A.曲线Ⅰ:滴加溶液到10 mL时: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |
按要求填写下列相关内容:
(1)在常温下,将体积为VaL、pH为a的稀硫酸和体积为VbL、pH为b的烧碱溶液混合,若所得混合液为中性。如果a+b=15,则Va:Vb=___________。某温度时,水的离子积常数Kw=1×10-13.在此温度下,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,如果a+b=12,则Va:Vb=___________。
(2)中和相同体积,相同pH的Ba(OH)2、NH3·H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为______________(用“V1、V2、V3”和“>、<、=”表示)。
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸。
①在同体积、同pH的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是___________。(填酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是__________,反应所用时间长短关系是_____________。
两只密闭容器A和B,A保持温度、容积不变;B保持温度、压强不变。起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;向左、向右、不移动;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;向左、向右、不移动;增大、减小、不变)。
(1)达到平衡所需要的时间:t(A)_________t(B),SO2的转化率:a(A)________a(B)
(2)起始时两容器中的反应速率:v(A)________v(B),反应过程中的反应速率:v(A)________v(B)。
(3)达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向________反应方向移动,B中的化学反应速率________。
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的百分含量________,B容器中SO2的百分含量________。
工业制备氯化铜时,将浓盐酸用蒸汽加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拌,使之溶解,得到强酸性的混合溶液。现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤:
参考数据:pH≥9.6时,Fe2+完全沉淀;pH≥6.4时,Cu2+完全沉淀;pH≥3.7时,Fe3+沉淀。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?_______(填“能”或“不能”),理由是________。
(2)有人用强氧化剂Ca(ClO)2将Fe2+氧化为Fe3+:
①加入Ca(ClO)2后,溶液的pH变化是_______(填代号)。
| A.可能减小 | B.一定减小 | C.可能增大 | D.一定增大 |
②你认为用Ca(ClO)2做氧化剂是否妥当?________,理由是______________________。
③现有下列几种常用的氧化剂,适合用于除去混合溶液中Fe2+的有______(有几个选几个,填代号)。
A Cl2 B KMnO4 C 浓HNO3 D O2 E H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________(有几个选几个,填代号)。
A Cu2(OH)2CO3 B 氨气 C CuO D Na2CO3 E NaOH F Cu(OH)2
A、B、C、D、E五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol/LC与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是__________,(填化学式,下同)E是__________;
(2)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中__________曲线(填写序号).
(3)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为__________.
(4)写出C的稀溶液和足量的D溶液反应的离子方程式______________________。
(1)常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①0.2mol/LHCl溶液中由水电离出的c(H+)__________0.2mol/LMOH溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_________mol/L。
(2)常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH>7,则说明在相同条件下MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,则混合溶液的pH_______。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示:
| 实验序号 |
0.1032mol/LHCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
25.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为_________mol/L。(保留四位有效数字)。
②下列情况可能引起测定结果偏高的是__________。
A.锥形瓶未用待测液润洗
B.酸式滴定管未用标准盐酸溶液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10-10 |
5.0×10-13 |
8.3×10-17 |
2.0×10-48 |
1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________。
A.KI B.K2CrO4 C.KBr D.K2S
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图

假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号