工业制备氯化铜时,将浓盐酸用蒸汽加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拌,使之溶解,得到强酸性的混合溶液。现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤:
参考数据:pH≥9.6时,Fe2+完全沉淀;pH≥6.4时,Cu2+完全沉淀;pH≥3.7时,Fe3+沉淀。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?_______(填“能”或“不能”),理由是________。
(2)有人用强氧化剂Ca(ClO)2将Fe2+氧化为Fe3+:
①加入Ca(ClO)2后,溶液的pH变化是_______(填代号)。
| A.可能减小 | B.一定减小 | C.可能增大 | D.一定增大 |
②你认为用Ca(ClO)2做氧化剂是否妥当?________,理由是______________________。
③现有下列几种常用的氧化剂,适合用于除去混合溶液中Fe2+的有______(有几个选几个,填代号)。
A Cl2 B KMnO4 C 浓HNO3 D O2 E H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________(有几个选几个,填代号)。
A Cu2(OH)2CO3 B 氨气 C CuO D Na2CO3 E NaOH F Cu(OH)2
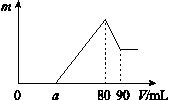
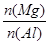 的最大值是____________。
的最大值是____________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号