在1 L HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol/l,向该溶液中加入足量铜粉,加热,充分反应,当HNO3与H2SO4的物质的量比为x:y 时所得溶液中Cu2+物质的量浓度最大,则x:y为
| A.3:8 | B.2:3 | C.1:4 | D.1:1 |
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解
成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3=5N2+6H2O;
②6NO2+8NH3=7N2+12H2O;③NO+NO2+2NH3=2N2+3H2O下列说法正确的是( )
| A.NOx主要来自于汽车尾气的排放,是引起温室效应的主要气体之一 |
| B.N2中π键与σ键之比为1:2 |
| C.反应③中每生成22.4LN2,转移电子数1.5NA |
| D.NH3的沸点比PH3的沸点高 |
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是
| A.还原性:HSO3->I-,氧化性:IO3->I2>SO42- |
| B.a点处的氧化产物是SO42-,还原产物是I- |
| C.当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol |
| D.若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O |
用0.1 mol/L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是
| A.+4 | B.+3 | C.+2 | D.+1 |
向含有1molFeCl2的溶液中通入0.2molCl2,再加入含0.1molX2O72-的酸性溶液,使溶液中Fe2+恰好全部被氧化为Fe3+,并使X2O72-还原为Xn+,则n值为( )
| A.2 | B.3 | C.4 | D.6 |
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。下列叙述不正确的是
| A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL |
| B.当金属全部溶解时收集到NO气体的体积一定为2.24 L |
| C.参加反应的金属的总质量3.6 g<m<9.6 g |
| D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是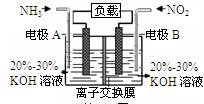
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.A电极上发生氧化反应,B为正极 |
| C.电极A极反应式为2NH3-6e-=N2+6H+ |
| D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol |
0.3molSO32-恰好将0.2molXO4-离子还原,则X元素在还原产物中的化合价是( )
| A.+1 | B.+2 | C.+3 | D.+4 |
氧化还原反应实际上包含氧化和还原两个过程:(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为SO2+2H2O-2e-=SO42-+4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为Cl2+2e-=2Cl-。已知在(1)和(2)中的反应均会生成产物X,则X的化学式为( )
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |
下列比值为2∶1的是
| A.pH=2与pH=1的硝酸中c(H+)之比 |
| B.Na2CO3溶液中c(Na+)与c(CO32ˉ )之比 |
| C.0.2mol/L与0.1mol/L醋酸中c(H+)之比 |
| D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为 |
取铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896L NO2气体和0.672 L N2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g。则合金中铜与镁的物质的量之比等于
| A.1 :1 | B.2 :1 | C.3 :2 | D.2 :3 |
已知酸性高锰酸钾溶液可以将FeSO4氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是
| A.方程式中的X为2MnSO4 |
| B.氧化性:KMnO4>Fe3+>I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol |
| D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-===2Fe2++I2 |
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量OH− 外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。试问原混合气体中Cl2与HCl体积比为
外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。试问原混合气体中Cl2与HCl体积比为
| A.5:2 | B.3:1  |
C.2:5 | D.1:1 |
硫代硫酸钠可用作脱氯剂,已知25.0 mL 0.1 mol·L-1的Na2S2O3溶液恰好把标准状况下112 mL Cl2完全转化为Cl-时,S2O32-转化成
| A.S2- | B.S | C.SO32- | D.SO42- |