将3.20 g Cu跟30.0 mL 10 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3-的物质的量为
| A.0.5a mol | B.2a mol |
| C.0.1a mol | D.(0.1+a)mol |
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是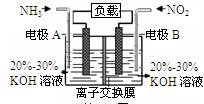
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.A电极上发生氧化反应,B为正极 |
| C.电极A极反应式为2NH3-6e-=N2+6H+ |
| D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol |
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )

| A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 |
| B.图中C点对应溶液体积为48mL |
| C.原硝酸溶液中含硝酸的物质的量为0.5mol |
| D.样品中铝粉和铁粉的物质的量之比5:3 |
Fe与硝酸反应随温度和硝酸的浓度不同而产物不同。已知0.2molHNO3做氧化剂时,恰好把0.4molFe氧化为Fe2+,则HNO3将被还原成
| A.NH4+ | B.N2O | C.NO | D.NO2 |
在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为
| A.2:1 | B.1:2 | C.1:3 | D.1:4 |
24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL浓度0.02mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
| A.+2 | B.+3 | C.+4 | D.+5 |
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为V2+-e-====V3+,下列说法正确的是
| A.放电时,右槽发生还原反应 |
| B.放电时,左槽电解液pH升高 |
| C.充电时,阴极的电极反应式:VO2++2H++e-====VO2++H2O |
| D.充电时,每转移1 mol电子,n(H+)的变化量为1 mol |
0.3molSO32-恰好将0.2molXO4-离子还原,则X元素在还原产物中的化合价是( )
| A.+1 | B.+2 | C.+3 | D.+4 |
已知某强氧化剂[RO(OH)2]2+离子2.4×10-3mol被亚硫酸钠还原到较低价态,需12mL0.2mol/L的亚硫酸钠溶液,则反应后R的化合价为
| A.0 | B.+2 | C.+3 | D.+4 |
铝可与硝酸钠发生反应(未配平):Al+NaNO +H
+H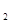 O
O Al(OH)
Al(OH) +N
+N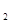
 +NaAlO
+NaAlO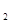 ,有关叙述正确的是
,有关叙述正确的是
| A.上述反应中水是氧化剂 |
B.若反应过程中转移5 mol e 则生成标准状况下N 则生成标准状况下N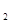 的体积为11.2L 的体积为11.2L |
C.该反应的氧化产物是N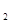 |
D.当消耗1 mol Al时,生成标况下N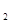 的体积为22.4L 的体积为22.4L |
将3.84g铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体2.24L(标准状况下),则所消耗酸的物质的量是
| A.0.11mol | B.0.22mol | C.0.16mol | D.0.1mol |
将一定量的锌与200 mL 18.5 mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况)。将反应后的溶液稀释到2 L,测得溶液中c(H+)=1mol·L-1,则下列叙述中错误的是
| A.反应中共转移电子3mol |
| B.反应中共消耗锌97.5 g |
| C.气体A中SO2和H2的体积比为4∶1 |
| D.稀释后的溶液中c(SO42―)="1.55" mol·L-1 |
已知酸性条件下有以下反应关系: ①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2。②Br2能将I-氧化为I2。③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2。现向含有1 mol KI的硫酸溶液中加入含amol KBrO3的溶液,a的取值不同,所得产物也不同。下列判断正确的是:
| 编号 |
a的取值范围 |
产物的化学式 |
| ① |
a≤1/6 |
I2、Br- |
| ② |
1/6<a<1/5 |
I2、Br-、Br2 |
| ③ |
1/5<a<6/5 |
I2、IO3-、Br2 |
| ④ |
a≥6/5 |
IO3-、Br2 |
A.①③④ B.②③④ C.①②③④ D.①④
向13.6 g由Cu和Cu2O组成的混合物中加入一定浓度的稀硝酸250 mL,当固体物质完全溶解后生成Cu(NO3)2和NO气体。在所得溶液中加入0.5 mol/L的NaOH溶液1.0 L,生成沉淀质量为19.6 g,此时溶液呈中性且金属离子已完全沉淀。下列有关说法正确的是
| A.原固体混合物中Cu与Cu2O的物质的量之比为1:1 |
| B.原稀硝酸中HNO3的物质的量浓度为1.3 mol/L |
| C.产生的NO的体积为2.24 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.1 mol |