安徽省安庆五校联盟高三下学期3月联考理综化学试卷
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关该反应的说法正确的是
| A.NF3分子中所有原子共平面 |
| B.NF3在反应中既做氧化剂又做还原剂 |
| C.生成0.2mol HNO3时转移0.2mol电子 |
| D.氧化产物与还原产物的物质的量之比为2∶1 |
NA为阿伏加德罗常数,下列说法中正确的是
| A.100mL 1mol·L-1AlCl3溶液中含的阳离子数等于0.1NA |
| B.标准状况下,22.4L CCl4中含有的CCl4分子数为NA |
| C.将2mL 0.5mol·L-lNa2SiO3溶液滴入稀盐酸中制得H2SiO3胶体,所含胶粒数为0.001NA |
| D.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
| A.PH大于7的溶液:Na+、Ba2+、SO32-、ClO— |
| B.含有0.1 mol·L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl- |
| C.使酚酞试液变红色的溶液:Na+、Ba2+、I-、Cl- |
| D.由水电离产生的c(H+)=10-13mol·L-1的溶液:NH4+、SO42-、NO3-、Cl- |
实验设计是化学实验的重要技能之一。用所给装置(夹持装置省略)完成相关实验,最合理的选项是
| A.图①中KMnO4溶液紫红色褪去,说明SO2具有漂白性 |
| B.图②能构成铜锌原电池 |
| C.图③利用排空气法收集二氧化碳 |
| D.图④检查装置气密性 |
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是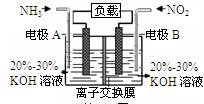
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.A电极上发生氧化反应,B为正极 |
| C.电极A极反应式为2NH3-6e-=N2+6H+ |
| D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol |
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) ⇌2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法不正确的是
| A.该温度下此反应的平衡常数K=1.44 |
| B.其他条件不变,升高温度,反应达到新平衡前V(逆)< V (正) |
| C.反应前2 min的平均速率v (Z)=4.0×10-3mol/(L·min) |
| D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.0.1mol·L-1NaHCO3溶液中的粒子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+2c(A-)=c(H+)+2c(HA)
X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
双原子分子单质在标准状况下密度为1.429g/L |
| Z |
单质及其化合物的焰色反应为黄色 |
| W |
W元素基态原子的M层全充满,N层只有一个电子 |
(1)X位于元素周期表位置为第第__________周期第_________族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
(2)X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 的 键和
键和 键的个数比是 。
键的个数比是 。
(3)Z2Y2中含有的化学键类型有 ;W的基态原子核外电子排布式是 。
(4)废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
①A(s)+H2SO4(aq) ="=" ASO4 (aq) + H2(g) ΔH=+64.4kJ·mol-1
②2H2O2(l) ="=" 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
③H2(g)+ O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示): 。
ZnO是电镀、涂料、有机合成等化学工业的重要原料。某课题组设计由含锌工业废料(含Fe、Cu、Mn等杂质)生产ZnO的工艺流程如下:
已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
2Cu +O2 +2H2SO4 == 2CuSO4+2H2O
(1)步骤①的浸取液里除含有Zn2+、Mn2+以外,还含有的金属离子有 、 ,所加试剂X为Na2SO4和_________的混合液。
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式_________________________,步骤③加入的试剂是_______,整个工艺流程中可以循环使用的试剂是_____________。
(3)步骤⑤中检验沉淀是否洗涤干净的操作方法是____________________________。
(4)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品7.18 g,充分灼烧后测得残留物质量为4.86 g,将所得气体通入足量澄清石灰水中,得到2.00 g沉淀,则此碱式碳酸锌的化学式是________________。
(本题共15分)
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②Mg(ClO3)2、NaClO3 、MgCl2 、NaCl 四种
化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)加速卤块在KMnO4溶液中溶解的措施有: (写出一点即可)。
(2)加入MgO的作用是 ;过滤后所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制 Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;② ;③ ;④过滤洗涤。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.0 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热,将Fe2+氧化成Fe3+。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次
(4)①写出步骤2中发生反应的离子方程式: ;
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果 (填“偏大”、 “偏小”或“不变”);
(5)若平均消耗K2Cr2O7 溶液15.00 mL,则产品中Mg(ClO3)2·6H2O的质量分数为 。
某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知NaHSO3与过量KIO3反应分为以下两步进行,第一步为IO3-+ 3HSO3-=3SO42-+3H+ + I-,则第二步反应的离子方程式为_____________________________
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的反应速率的影响。调节反应物浓度和温度进行对比实验,记录如下:
| 实验编号 |
0.02mol/LNaHSO3溶液/mL |
0.02mol/LKIO3溶液/mL |
H2O/mL |
反应温度/℃ |
溶液变蓝的时间t/s |
| ① |
15 |
20 |
10 |
15 |
t1 |
| ② |
a |
30 |
0 |
15 |
t2 |
| ③ |
15 |
b |
c |
30 |
t3 |
实验①②是探究______________对反应速率的影响,表中a=________;实验①③是探究温度对反应速率的影响,则表中b=________,c=________
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO42-对反应起催化作用,SO42-浓度越大反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
假设三:__________________________________________________________;
……
(4)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)
| 实验步骤(不要求写出具体操作过程) |
预期实验现象和结论 |
| |
|
 粤公网安备 44130202000953号
粤公网安备 44130202000953号