将3.2g铜与过量硝酸(8mol/L,30ml)充分反应后,硝酸的还原产物为NO2和NO ,反应后溶液中含a mol H+,则此溶液中所含NO3-的物质的量为
| A.(0.2+a)mol | B.(0.1+a)mol | C.(0.05+a)mol | D.amol |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量为0.2 mol,则NaOH的浓度为
| A.2mol/L | B.1.8mol/L | C.2.4 mol/L | D.3.6 mol/L |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成甲、乙两份。向甲中逐渐加入铜粉,最多能溶解9.6g铜粉。向乙中逐渐加入铁粉,最多能溶解14.0g铁粉。 (假设硝酸只被还原为NO气体)。下列分析或结果错误的是
| A.原混合酸中NO3—物质的量为0.1 mol |
| B.乙中最多产生气体是0.2mol |
| C.原混合酸中HNO3浓度为1.0 mol·L-1 |
| D.原混合酸中H2SO4浓度为2.5 mol·L-1 |
全钒液流电池是一种新型电能储存和高效转化装置。某溶液中含有VO2+和Cr2O72-,现向其溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好是VO2+→VO2+,Cr2O72-→Cr3+.再滴入2.OOmL0.02000mol/L的KMnO4溶液,又恰好是VO2+→VO2+,而Cr3+不变,此时MnO4-→Mn2+,则原溶液中Cr元素的质量为
| A.156 mg | B.23 4 mg | C.31.2 mg | D.46.8mg |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是
| A.2.24g | B.3.36g | C.5.60g | D.10.08g |
有一混合溶液,其中只含 有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数
有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数
比为2∶ 3∶4,向该溶液中通入氯气,使溶液中Cl- 和Br-的个数比为3∶1,则通入氯气的物质的量与溶液
3∶4,向该溶液中通入氯气,使溶液中Cl- 和Br-的个数比为3∶1,则通入氯气的物质的量与溶液 中剩余的Fe2+的物质的量之比为
中剩余的Fe2+的物质的量之比为
| A.7∶1 | B.7∶3 | C.7∶2 | D.7∶4 |
0.44 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体336 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到0.78 g沉淀。下列说法正确的是
| A.该合金中铜与镁的质量量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是7.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到0.78 g沉淀时,加入NaOH溶液的体积是1380mL |
某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
| A.NO2 | B.NO | C.N2O | D.N2 |
将一定量硫酸、硝酸和KNO3溶液混合成100ml溶液,其中H2SO4、HNO3和KNO3的物质的量浓度分别是6mol/L,2mol/L和1mol/L,向其中加入过量的铁粉,可产生标准状况下的混合气体体积为
| A.11.2 L | B.6.72 L | C.8.96 L | D.4.48 L |
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的氢离子浓度为0.1 mol/L,下列叙述不正确的是
| A.反应中共转移3 mol电子 |
| B.反应中共消耗1.8 mol H2SO4 |
| C.反应中共消耗97.5 g Zn |
| D.气体甲中SO2与H2的体积比为4:1 |
4.6g铜和镁的合金完全溶于浓硝酸,反应后硝酸被还原只生成4480mL的NO2气体和336mL的N2O4气体(气体体积都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
| A.9.02g | B.8.51g | C.8.26g | D.7.04g |
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是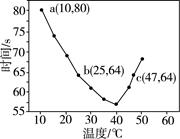
| A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3的反应速率相等 |
| C.图中a点对应的NaHSO3的反应速率为5.0×10-5 mol·(L·s)-1 |
| D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂 |
已知适当条件下+7、+6、+4价锰的化合物都能和浓盐酸反应制得氯气且还原产物都是MnCl2.将6.32g KMnO4粉末加热一段时间后收集到0.112L气体(标准状况,后同),冷却后放入足量的浓盐酸再加热,又收集到VL黄绿色气体,下列说法正确的是
| A.V=2.24L |
| B.参加反应的HCl为0. 18mol |
| C.无法确定最终生成含钾化合物的数量是多少 |
| D.6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2(标准状况) |
硫代硫酸钠(Na2S2O3)可作为还原剂,已知25.0mL0.0100mol/LNa2S2O3溶液恰好把22.4mL(标准状况下)Cl2完全转化为Cl 离子, 则S2O32- 将转化成( )
离子, 则S2O32- 将转化成( )
| A.S2- | B.S | C.SO32- | D.SO42- |