已知NH4CuSO3与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.1molNH4CuSO3完全反应转移0.5mol电子 |
将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体(NOx)的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为
| A.0.05 mol | B.0.13 mol | C.1.05 mol | D.1 mol |
已知酸性条件下有以下反应关系: ①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2。②Br2能将I-氧化为I2。③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2。现向含有1 mol KI的硫酸溶液中加入含amol KBrO3的溶液,a的取值不同,所得产物也不同。下列判断正确的是:
| 编号 |
a的取值范围 |
产物的化学式 |
| ① |
a≤1/6 |
I2、Br- |
| ② |
1/6<a<1/5 |
I2、Br-、Br2 |
| ③ |
1/5<a<6/5 |
I2、IO3-、Br2 |
| ④ |
a≥6/5 |
IO3-、Br2 |
A.①③④ B.②③④ C.①②③④ D.①④
向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是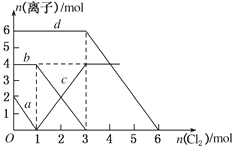
| A.d曲线代表溶液中Br-变化情况 |
| B.原溶液中FeI2的物质的量为2 mol |
| C.原溶液中n(Fe2+):n(Br-)=2:3 |
| D.当通入2 mol Cl2时,溶液中离子反应为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是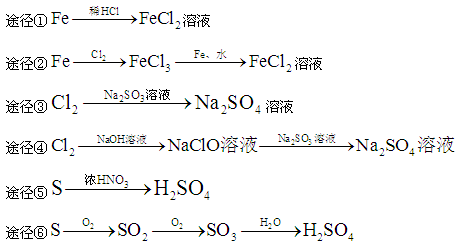
| A.由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- |
| B.由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C.由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D.以上说法都不正确 |
PbO2受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为1:1,则剩余固体的组成及物质的量比可能是
| A.1:2:1混合的PbO2、Pb3O4、PbO |
| B.1:3:2混合的PbO2、Pb3O4、PbO |
| C.1:1:1混合的PbO2、Pb3O4、PbO |
| D.2:1:1混合的PbO2、Pb3O4、PbO |
某温度下,将C12通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定NaClO与NaClO3的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
| A.21:5 | B.11:3 | C.3:1 | D.4:1 |
根据表中信息判断,下列选项正确的是
| A.第①组反应的其余产物为H20 |
| B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 |
| C.第③组反应中生成1 mol Cl2,转移电子5 mol |
| D.氧化性由强到弱顺序为Mn04->Cl2 >Fe3+>Br2 |
一定量的KMnO4与足量的250mL浓盐酸反应,方程式为2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O,反应结束后,共转移电子为5mol,则还原产物中,阳离子的物质的量浓度为(溶液的体积变化忽略不计)( )
| A.1mol/L | B.2mol/L | C.4mol/L | D.8mol/L |
将3.48gFe3O4完全溶解在100mL 1mol·L-1 H2SO4溶液中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部反应完,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度为
| A.0.033mol·L—1 | B.0.3mol·L—1 | C.0.2mol·L—1 | D.0.1mol·L—1 |
已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子生成SO42-离子;又知反应中氧化剂与还原剂的离子数之比为5:2,则S2O8n-中的n值和S元素的化合价是
| A.2, +6 | B.2, +7 | C.4 ,+6 | D.4 , +7 |
羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL 0.04mol/L的羟胺的酸性溶液跟30.00mL 0.02 mol/L的KMnO4酸性溶液完全作用。已知MnO4- →Mn2+则在上述反应中,羟胺的氧化产物是
| A.NO | B.N2O | C.N2 | D.NO2 |
在含有nmolFeI2的溶液中通入Cl2,有xmolCl2发生反应,下列说法正确的是( )
| A.当x≤0.5n时,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl- |
| B.当x≥n时,反应的离子方程式为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| C.当Fe2+和I-都被氧化时,x的最小值须大于0.5n |
| D.当x=n时,反应后氧化产物的物质的量为nmol |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2 、H2SO4 |
K2SO4、MnSO4...... |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4-... |
Cl2、Mn2+、H2O |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4-> Cl2 > Fe3+ > Br2