乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x的值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗了10.00mL。
请回答下列问题:
(1)滴定时,将酸性KMnO4标准液装在如图中的 (填“甲”或“乙”)滴定管中。
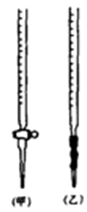
(2)本实验滴定达到终点的标志是 。
(3)通过上述数据,求得x= 。讨论:
①若滴定终点时俯视滴定管,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2 = 2NaNO2
②2NO2 + Na2O2 = 2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2: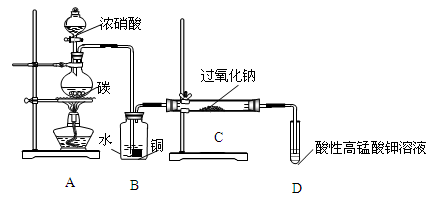
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移
的方向和数目 。
(2)B装置的作用是 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂。
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论) 。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 |
1 |
2 |
3 |
4 |
| KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是 (双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(结果保留4位有效数字)
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下: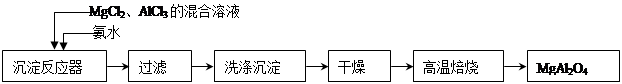

(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如图所示,过滤操作中的一处错误是 。
判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固 体的仪器名称是 。
(3)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_________________沉淀(填化学式),生成该沉淀的离子方程式_____________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]="3×10" -34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(5)将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)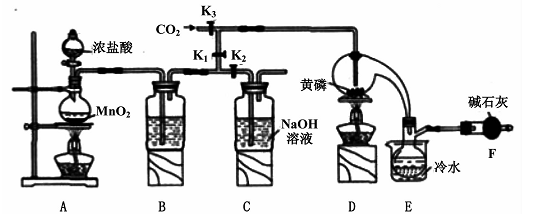
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 ,F中碱石灰的作用是 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POC13、PCl5等。加入黄磷加热除去PCl5后.通过 (填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml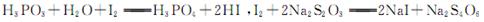 已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2 2KMnO4+MnO2↓+2K2CO3
2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 |
K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
| 溶解度g/100g |
111 |
33.7 |
11.1 |
6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填序号)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
加酸时不宜用硫酸的原因是: ;不宜用盐酸的原因是( )
(2)K2MnO4的转化2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(3)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知 涉及到的反应:Na2C2O4+ H2SO4→H2C2O4(草酸)+Na2SO4
5H2C2O4+ 2MnO4—+6H+→2Mn2++10CO2↑+ 8H2O
Ⅰ 称取0.80 g的高锰酸钾产品,配成50 mL溶液。
Ⅱ 称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL,则样品中高锰酸钾的质量分数为 (保留3位小数)。达到滴定终点的标志是 。
(4)加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
(5)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,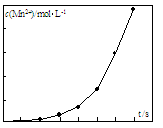
其原因可能为 。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下:
已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。
(1)“调节pH=4”可选用的试剂是 (填编号)。
①MgO ②CuO ③MgCO3 ④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是 。
(3)“滤渣”的主要成分为 。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:①蒸发、浓缩、结晶;② ;③ ;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 。
(6)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式: 。
②产品中Mg(ClO3)2•6H2O的质量分数为 。
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
资料:氰化钠化学式NaCN(C元素+2价,N元素-3价),白色结晶颗粒、易潮解、有微弱的苦杏仁气味、剧毒、易溶于水、易水解生成氰化氢、水溶液呈碱性。
(1)氰化钠(NaCN)溶液呈碱性,其原因是____________(用离子方程式解释)。
(2)“8.12”爆炸事故后,当地政府组织群众用双氧水喷洒,用双氧水处理NaCN产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式____ 。
某化学兴趣小组在实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如右图所示装置制备Na2S2O3。

(3)右图a装置中盛装Na2SO3
固体的仪器名称是______________;
b装置的作用是________________。
(4)装置c中的产物有Na2S2O3和C02气体等,实验结束后,装置d中的溶质有NaOH、Na2CO3,还可能有________________________。
(5)实验结束后,在e处最好连接盛______________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。已知:
①废水中氰化钠的最高排放标准为0.50 mg/L。
②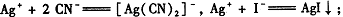 AgI呈黄色,且CN -优先与Ag+反应。
AgI呈黄色,且CN -优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
(6)滴定终点的判断方法是_______________。
(7)处理后的废水中氰化钠的含量为_____________mg/L。
铁的单质和化合物在实验和实际生产中都有重要作用。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
| 操作 |
现象 |
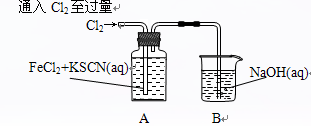 |
现象1:A中溶液变红 现象2:稍后,溶液由红色变为黄色 |
(1)B装置中反应的化学方程式____________ _ _______________ _______。
(2)A中溶液变红的原因是____________________ _ _________________________。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_ _。
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+与SCN-生成红色Fe(SCN) 3的反应 可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为 ,
,
离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为 个。
②若要检验产物中含有SO42-,常用的化学试剂是________(写试剂名称)。
Ⅱ.高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为______极,电极反应式为________________ __。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: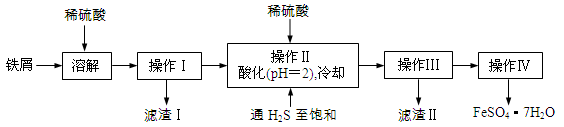
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为 ;操作II,在溶液中用硫酸酸化至pH=2的目的是 。
(2)操作IV的顺序依次为: 、 、过滤、洗涤、干燥。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② 。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。滴定时发生反应的离子方程式为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)。
①用硫酸酸化的0.01000 mol/LKMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。
②判断此滴定实验达到终点的方法是 。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 。
人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(Ca2C2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液定量反应即可测定血样样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。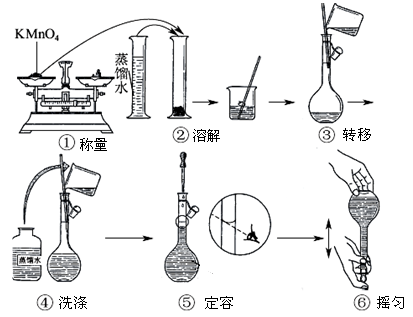
【实验探究一】配制酸性KMnO4标准溶液。如上图所示是配制100mL 酸性KMnO4标准溶液的过程示意图。
(1)请你观察图示判断其中不正确的操作有____________(填序号);
(2)其中确定100mL溶液体积的容器是____________(填名称);
(3)如果按照图示的操作所配制溶液进行实验,在其他操作均正确的情况下,所得KMnO4溶液浓度将_________(填“偏大”或“偏小”)。
【实验探究二】测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L 酸性KMnO4溶液与之反应,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mnx++10CO2↑+8H2O则式中的x=_________
(5)经过计算,血液样品中Ca2+的浓度为___________ mg/cm3。
(15分)电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
实验原理:CaC2+2H2O=Ca(OH)2+C2H2↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①取样品1.2g;
②把1.2 g样品放入气密性良好的气体发生装置,如图所示;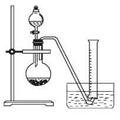
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平
④作为反应器的烧瓶中有24 mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、 、 、 。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,配平并完成化学方程式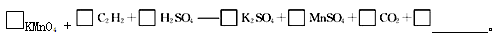
若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol • L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.01 mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4-+5HSO3-+H+ 2Mn2++5SO42-+3H2O。填空回答问题:
2Mn2++5SO42-+3H2O。填空回答问题:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少_____________________
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因:
(3)选何种指示剂,说明理由 ,到达终点时颜色变化
(4)当用酸滴定碱时,下列操作使测定结果(碱的浓度)偏高的是
① 酸式滴定管滴至终点,俯视读数
② 碱液移入锥形瓶后,加入10mL蒸馏水
③ 酸式滴定管注入酸溶液后,尖嘴有气泡时便开始滴定,滴定后无气泡
④ 酸式滴定管用蒸馏水润洗后,未用标准液润洗
(5)有关数据记录如下:
| 实验序号 |
待测液体积(mL) |
所消耗KMnO4酸性溶液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.60 |
| 2 |
20.00 |
6.00 |
25.90 |
| 3 |
20.00 |
1.40 |
24.20 |
则NaHSO3溶液的物质的量浓度为______________mol/L。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经混合物过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是 ;
(3)在配制标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的 (填字母代号)。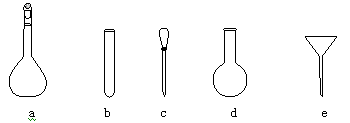
滴定终点的现象是__________________________________。
(4)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”): 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题。
(1)运输氯气的钢瓶上应贴的标签为_____________。
| A.腐蚀品 | B.爆炸品 | C.有毒品 | D.易燃品 |
(2)工业上将氯气通入石灰乳制取漂白粉,写出该反应的化学方程式 。
(3)漂白粉的有效成分是(填化学式)_____________。
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2。高锰酸钾溶液常用于物质的定性检验与定量分析。某化学兴趣小组在实验室里欲用KMnO4固体来配制500 mL 0.1mol/L的KMnO4溶液。
①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、 。
②下列操作会导致实验结果偏小的是 (填字母)。
a.转移时没有洗涤烧杯、玻璃棒
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.加水定容时俯视刻度线
③用配好的该浓度的KMnO4溶液与300mL 0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为 mL。(已知MnO4-在此条件被还原为Mn2+)
(5)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量,已知:Cl2 + 2Br-=2Cl-+ Br2)。
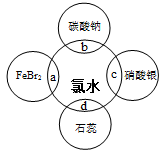
①能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”),现象是 。
②a中发生反应的离子方程式是 。
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
Ⅰ.称量4.910g三草酸合铁酸钾晶体,配制成250mL溶液。
Ⅱ.取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,滴加KMnO4溶液至草酸根(C2O42−)恰好全部氧化成二氧化碳,同时MnO4−被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至溶液的黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
Ⅲ.用0.01000mol/L KMnO4溶液滴定步骤Ⅱ所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4−被还原成Mn2+ 。
Ⅳ.重复步骤Ⅱ、步骤Ⅲ操作,滴定消耗0.01000mol/L KMnO4溶液19.98mL
请回答下列问题:
(1)滴定过程中需添加的指示剂是(若不需要请说明理由)
(2)加入锌粉的目的是 。
(3)写出步骤Ⅲ中发生反应的离子方程式 。
(4)实验测得该晶体中铁的质量分数为 ;X= 。
(5)在步骤Ⅱ中,若加入的KMnO4的溶液的量不够,则测得的铁含量 ;(选填“偏低”“偏高”“不变”,下同)若加入的锌粉的量不够,则测的铁的含量 。