四川省内江市高三上学期第三次模拟考试化学试卷
下列实验过程中,始终无明显现象的是
| A.O2通入酸化的KI淀粉溶液中 |
| B.CO2通入CaCl2溶液中 |
| C.0.1 mol.L-l稀H2SO4滴入0.1 mol.L-1 Na2S2O3溶液中 |
| D.0.2mol.L-1 H2C2O4溶液滴入酸化的KMnO4溶液中 |
下列反应的离子方程式书写正确的是
| A.氯化铝溶液中加入过量氨水:Al3++4 NH3·H2O==AlO2-+4NH4+ +2H2O |
| B.澄清石灰水与足量小苏打溶液混合: Ca2+ +2OH- +2 HCO3-==CaCO3+CO32-+2 H2O |
| C.食醋腐蚀大理石面板:CaCO3 +2 H+= Ca2+ +CO2 +H2O |
| D.少量钠投入硫酸铜溶液中:2Na +Cu2+="2" Na+ +Cu |
下列说法正确的是
| A.18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) |
| B.电解精炼铜时,每转移1 mol电子,阳极溶解铜的质量为32 g |
C.恒温恒容下,某可逆反应X(g)+Y(g)  Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H增大 Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H增大 |
| D.右图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |

短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。其中Z所处的周期序数与族序数相等。下列说法不正确的是
| A.形成简单离子的半径大小顺序:r(W)>r(Z)>r(Y) |
| B.最简单气态氢化物的热稳定性:Y>X |
| C.Q的氢化物的水溶液可用于蚀刻玻璃 |
| D.X、Z的最高价氧化物均可与NaOH溶液反应 |
下列说法正确的是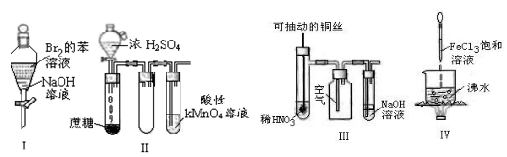
| A.实验I:充分振荡后静置,上层溶液颜色保持不变 |
| B.实验Ⅱ:酸性KMnO4溶液中出现气泡,但溶液颜色不变 |
| C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:煮沸至溶液呈红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
25℃时,对有关溶液的分析不正确的是
| A.将0.1 mol·L-l Na2CO3溶液加水稀释后,溶液中n(H+)·n(OH一)不变 |
| B.pH =2的醋酸溶液与pH =12的氢氧化钠溶液中水的电离程度相同 |
| C.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液中c(Na+):①>②>③ |
| D.C H3COONa和CaCl2混合溶液: |
c(Na+) +2c(Ca2+)=c(CH3COO-)+c( CH3COOH) +c( Cl-)
C、N、O、S、Mg、Fe等是中学化学中的常见元素。按要求回答下列问题:
(1)N元素在元素周期表中的位置是______________。
(2) H2S的沸点比H2O的沸点低的主要原因是__________________。
(3)已知:2 SO2(g) +O2(g)- 2 SO3(g) △H="-196.6" kJ·mol-l
2 SO3(g) △H="-196.6" kJ·mol-l
2 NO(g) +O2(g)  2 NO2(g) AH="-113.0" kJ·mol-l
2 NO2(g) AH="-113.0" kJ·mol-l
则反应NO2(g) +SO2(g)  SO3(g)+NO(g)的△H= kJ·mol-l
SO3(g)+NO(g)的△H= kJ·mol-l
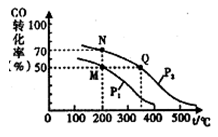
(4)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2 H2(g)  CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为 ;Pl P2(填“>、<或=”);平衡常数KM=__________。
CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为 ;Pl P2(填“>、<或=”);平衡常数KM=__________。
(5) Mg和Fe组成的合金是目前已发现的储氢密度最(高的储氢材料之一,其晶胞结构如图甲(白球代表Mg,黑球代表Fe)。则该合金的化学式为 。若该合金用M表示,某种储氢镍电池(MH - Ni电池)的结构如图乙所示。其电池反应为:MH+NiOOH Ni( OH)2 +M。下列有关说法不正确的是________。
Ni( OH)2 +M。下列有关说法不正确的是________。
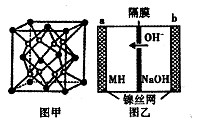
A.放电时正极反应为:NiOOH+H2O+e-= Ni(OH)2 +OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+ OH- - e-= H20+M
D.M的储氢密度越大,电池的比能量越高
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
资料:氰化钠化学式NaCN(C元素+2价,N元素-3价),白色结晶颗粒、易潮解、有微弱的苦杏仁气味、剧毒、易溶于水、易水解生成氰化氢、水溶液呈碱性。
(1)氰化钠(NaCN)溶液呈碱性,其原因是____________(用离子方程式解释)。
(2)“8.12”爆炸事故后,当地政府组织群众用双氧水喷洒,用双氧水处理NaCN产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式____ 。
某化学兴趣小组在实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如右图所示装置制备Na2S2O3。

(3)右图a装置中盛装Na2SO3
固体的仪器名称是______________;
b装置的作用是________________。
(4)装置c中的产物有Na2S2O3和C02气体等,实验结束后,装置d中的溶质有NaOH、Na2CO3,还可能有________________________。
(5)实验结束后,在e处最好连接盛______________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。已知:
①废水中氰化钠的最高排放标准为0.50 mg/L。
②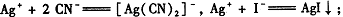 AgI呈黄色,且CN -优先与Ag+反应。
AgI呈黄色,且CN -优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
(6)滴定终点的判断方法是_______________。
(7)处理后的废水中氰化钠的含量为_____________mg/L。
化合物E常用于制备抗凝血药,可以通过如图所示路线合成。
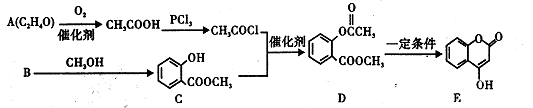
(1)B中含氧官能团的名称是____ ,检验A中官能团的试剂为 。
(2)B→C的反应类型为 ,1 mol E最多可与 molH2发生加成反应。
(3)写出D与足量NaOH溶液完全反应的化学方程式 。
(4)B有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式__________。
| A.能发生银镜反应 |
| B.核磁共振氢谱只有4个峰 |
| C.能与FeCI3溶液发生显色反应 |
| D.1 mol该同分异构体与NaOH溶液反应时,最多可消耗3mol NaOH。 |
(5)E的同分异构体很多,所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相
同,该仪-器是 (填标号)。
a.质谱仪 b.红外光谱 c.元素分析仪 d.核磁共振仪
铁及其化合物与生产、生活关系密切。

(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀的类型为__________腐蚀。
②图中A、B、C三点附近的区域内,腐蚀最严重的是 (填字母)。
(2)已知Fe3+、Fe2+、Cu2+在溶液中沉淀的pH如下表:

印刷电路铜板腐蚀剂常用FeCI3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol.L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①__ ;② ;③过滤。(提供的药品:Cl2、浓H2S04、NaOH溶液、CuO、Cu)
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
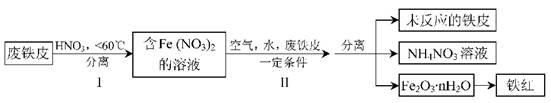
①向Fe(NO3)2溶液中加入稀盐酸,溶液颜色由浅绿色变为棕黄色,该反应的原理为______________(用离子方程式表示)。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,结合流程写出该反应的化学方程式为 。
(4)某铁质容器材料为碳素钢,可盛装冷浓硫酸。取5.60 g该材料放人15.0mL浓硫酸中加热,充分反应后得到溶液X并收集到气体Y。
①甲组通过实验确定了X中含有Fe3+,为检验X中是否还含有Fe2+,可另取X溶液加入 (填序号)。
A.KSCN溶液和氯水 B.K3[Fe(CN)6]溶液
C.NaOH溶液 D.酸性KMnO4溶液
②为分析气体Y中的成分,乙组将560 mL(标准状况)气体Y通入足量溴水,然后向该溶液中加入足量BaCl2溶液,过滤、洗涤、干燥后,称得沉淀质量为2.33 g。则气体Y通入足量溴水反应的离子方程式为____ ,参加该反应的气体在Y中的体积分数为 .

 粤公网安备 44130202000953号
粤公网安备 44130202000953号