将0.195 g锌粉加入到20.0 mL的0.100 mol/L MO2+溶液中,恰好完全反应, 则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
标准状况下,将a L H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b mol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO,且三者物质的量之比为8∶1∶1,则原混合气体中H2的物质的量为( )
| A.a/2 mol |
| B.(a/22.4-b)mol |
| C.(a/22.4-b/2)mol |
| D.b/2 mol |
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为( )
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.Cl2O3 | D.ClO2 |
某温度下将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
| A.2:1 | B.4:3 | C.1:3 | D.3:1 |
已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子生成SO42-离子;又知反应中氧化剂与还原剂的离子数之比为5:2,则S2O8n-中的n值和S元素的化合价是
| A.2, +6 | B.2, +7 | C.4 ,+6 | D.4 , +7 |
将3.48gFe3O4完全溶解在100mL 1mol·L-1 H2SO4溶液中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部反应完,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度为
| A.0.033mol·L—1 | B.0.3mol·L—1 | C.0.2mol·L—1 | D.0.1mol·L—1 |
在1000 mL含有等物质的量的HBr和H2SO3溶液中通入0.01 molCl2,有一半 变为Br2,原溶液中HBr和H2SO3的浓度都等于
变为Br2,原溶液中HBr和H2SO3的浓度都等于
A.0.007 5 mol· |
B.0.008 mol· |
C.0.075 mol· |
D.0.08 mol· |
在含有nmolFeI2的溶液中通入Cl2,有xmolCl2发生反应,下列说法正确的是( )
| A.当x≤0.5n时,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl- |
| B.当x≥n时,反应的离子方程式为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| C.当Fe2+和I-都被氧化时,x的最小值须大于0.5n |
| D.当x=n时,反应后氧化产物的物质的量为nmol |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3(已知还原性I->Fe2+>Br->Cl-),则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为
| A.5:4 | B.4:5 | C.5:12 | D.12:5 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+ cCl2↑+ d HClO4 +eH2O。下列有关说法不正确的是
| A.还原产物只有Cl2 |
| B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为: 3HClO3 =2O2↑+ C12↑+ HClO4 + H2O |
| C.由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20 |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的化学方程式是:4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法中错误的是
| A.高铁酸钾处理水时,水发生氧化反应 |
| B.湿法中每生成1mol Na2FeO4共转移3mol电子 |
| C.干法中每生成1mol Na2FeO4共转移4mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,并能使悬浮杂质沉降 |
aL某浓度的SnC12溶液与过量FeC13溶液充分混合后,再加入 L 0.2000 mol·L-1 K2Cr2O7溶液,恰好完全反应,则SnC12的浓度为
L 0.2000 mol·L-1 K2Cr2O7溶液,恰好完全反应,则SnC12的浓度为
(提示:①2Fe3++Sn2+=2Fe2++ Sn4+;②6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O)
+14H+=6Fe3++2Cr3++7H2O)
| A.0.3000 mol·L-1 | B.1.2000 mol·L-1 |
| C.0.0333 mol·L-1 | D.0.1333 mol·L-1 |
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。横、纵坐标的单位均为mol。
有关说法不正确的是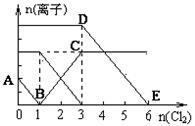
| A.线段BC代表Fe2+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=3 mol/L |
| C.原溶液中n (Fe2+): n (I-): n(Br-)=2:1:3 |
| D.当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
已知NH4CuSO3与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.1molNH4CuSO3完全反应转移0.5mol电子 |