期中备考总动员高三化学模拟卷【新课标II卷】6
【原创】近些年地球上地震、海啸、飓风时有发生,全球气温持续上升,部分冰川开始融化。为此我们应该用实际行动来保护我们的家园——地球,下列有关说法错误的是
| A.CO2、CH4、氟氯代烃等都会造成温室效应,因此都属于大气污染物 |
| B.推广可利用太阳能、风能的城市照明系统有利于节能减排和改善环境 |
| C.低碳经济主要与工厂、汽车排放有关,与人们用电、用水、用纸等是否节约无关 |
| D.绿色化学的核心是利用化学原理对环境污染进行治理 |
【改编】某有机物的结构如图所示,则下列说法中不正确的是
| A.该有机物的分子式为C11H12O3 |
| B.该有机物能能使溴的四氯化碳溶液或酸性高锰酸钾溶液褪色 |
| C.1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |
| D.该有机物能发生加成反应但不能发生取代反应 |
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
下列说法正确的是
| A.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si |
| B.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物 |
| C.若甲为金属单质,乙为非金属单质,则甲只能是Mg |
| D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2 |
【改编】下列实验能达到预期目的是
| 选项 |
实验内容 |
实验目的 |
| A. |
测同温同浓度下的Na2CO3和Na2SO3水溶液的pH |
确定碳和硫两元素非金属性强弱 |
| B. |
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 |
证明溶液中有NH4+ |
| C. |
取久置的Na2SO3溶于水,加硝酸酸化的BaCl2溶液 |
证明Na2SO3部分被氧化 |
| D. |
用稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
证明氧化性:H2O2比Fe3+强 |
0.44 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体336 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到0.78 g沉淀。下列说法正确的是
| A.该合金中铜与镁的质量量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是7.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到0.78 g沉淀时,加入NaOH溶液的体积是1380mL |
N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是
| A.通入N2的电极发生的电极反应式为:N2 + 6e- + 8H+="=" 2NH4+ |
| B.反应过程中溶液的pH会变大,故需要加入盐酸 |
| C.该电池外电路电流从通入H2的电极流向通入N2的电极 |
| D.通入H2的电极为负极,A为NH4Cl |
【改编】下列说法正确的是
| A.已知CO(g)的燃烧热ΔH=-283.0 kJ·mol-1,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ/mol |
| B.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多。 |
C.在稀溶液中, ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
| D.由N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ |
【原创】据中国地震台网测定,3月30日在贵州省黔东南苗族侗族自治州发生5.5级地震,据了解,这已经是贵州这个月以来发生的第三次地震。饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究。
(1)下面是某同学从超市购买的某品牌消毒液包装说明查询到的部分内容:主要有效成分为次氯酸钠,有效氯含量8 000~ 10 000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。本品须密封,置阴凉暗处保存。据此分析:
①室温时,他测得该消毒液(NaClO)的pH_______7(填“>”、“=”或“<”),其原因为(用离子方程式表示)_________________________。
②该消毒液还具有的化学性质有____(填序号)
| A.强氧化性 | B.强还原性 | C.不稳定性 | D.漂白性 |
③从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)_________________。
④日常生活中也常用明矾作净水剂,用离子方程式表示其净水原理___________________。
(2)该学习小组同学用石墨和饱和食盐水设计了如图所示的装置,进行消毒液( NaClO 溶液)制备,通电时,电解饱和食盐水的化学方程式为_________________;为使生成的Cl2完全被吸收,则电源的a极应为___极(填“正”或“负”),溶液中生成NaClO的离子方程式为____________________。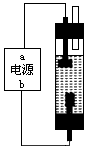
钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题:

(1)上述流程中通入空气的目的是 ;
(2)滤渣A与硫酸反应的离子方程式为 ;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图:

已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中
电极 (填“A”或“B”)相接,气体Y为气体出口 (填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为 ,写出锌锰碱性电池正极反应式 ;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因 ;
(5)将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。

(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因: 。
(3)将装置C中两种液体分离开的操作名称是 。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为 。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是 。
(3)由MgCl2溶液得到MgCl2·6H2O晶体,操作为 、 、
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是: 。
②由MgCl2·6H2O加热制备无水MgCl2的操作在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
[化学—选修2化学与技术](15分)空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下:

(1)目前,从海水中提取的溴约占世界溴年产量的 。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
(3)步骤④的离子方程式为 。
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80〜90℃。温度过高或过低都不利于生产,理由是 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是 ,分离时液溴从分离器 (填“上口”或“下口")排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、S02吸收、氯化”的原因是 。
(7)某同学测得苦卤中溴的含量为0.8g/L,已知步骤①〜⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴 mol。
【化学-选修3物质结构与性质】(15分)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_______个未成对电子,Fe3+的电子排布式为_________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为____________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的 键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数 nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g
nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g cm-3。
cm-3。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号