江西省新余市高一上学期期末考试化学试卷
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
| A.2010年11月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| B.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 |
| C.小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| D.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
下列叙述中正确的是
| A.硫酸的摩尔质量是98g |
| B.铁原子的摩尔质量等于铁的相对原子质量 |
| C.标准状况下,22.4L的O2质量是32g |
| D.2g H2所含原子物质的量为1mol |
下列离子方程式书写正确的是
| A.向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O =AlO2—+ 4NH4++2H2O |
| B.铁与稀盐酸反应: 2Fe+6H+ = 2Fe3++3H2↑ |
| C.氢氧化钡和稀硫酸: Ba2++2OH—+2H++SO42—=BaSO4↓+2H2O |
| D.将钠加入水中: Na+2H2O=Na++2OH—+H2↑ |
“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③能产生丁达尔效应 ④不能透过滤纸 ⑤能透过滤纸 ⑥静置后会析出黑色沉淀
| A.①④⑤ | B.②③④ | C.②③⑤ | D.①③④⑥ |
下列有关金属及其化合物的知识说法正确的是
| A.观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+ |
| B.金属单质导电与电解质溶液导电原因是一样的 |
| C.常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸 |
| D.可用Na与MgCl2溶液反应制Mg |
下列各组离子在指定溶液中能大量共存的是
| A.无色溶液中:K+、Na+、MnO4—、SO42— |
| B.在酸性溶液中:Ba2+、Na+、SO42—、Cl— |
| C.加入Al能放出H2的溶液中:Cl—、HCO3—、SO42—、NH4+ |
| D.含大量Fe2+溶液中:K+、Cl—、SO42-、Na+ |
除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下试剂及操作:①Na2CO3 ②BaCl2 ③NaOH ④HCl ⑤过滤。加入试剂及操作合理的顺序是
| A.①②③⑤④ | B.③①⑤②④ | C.③②①⑤④ | D.④②①⑤③ |
NA为阿伏加德罗常数,下列叙述正确的是
| A.11.2 L氧气中所含有的原子数为NA |
| B.标准状况下,22.4LCCl4所含分子数为NA |
| C.7.8g的Na2O2中含有的阴离子的数目为0.2NA |
| D.27g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是3NA |
已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl=3Cl2+KCl↑+3H2O,③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| C.反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol, |
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,下表中符合图示情况的是
| |
A |
B |
C |
D |
| X |
CO2 |
HCl |
NaOH |
AlCl3 |
| Y |
Ca(OH)2 |
NaAlO2 |
AlCl3 |
NaOH |
有Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸溶液中,混合物完全溶解,当加入250mL2.0mol/L的NaOH溶液时,得到的沉淀最多。则盐酸溶液的浓度为
| A.0.5mol/L | B.1.0mol/L | C.2.0mol/L | D.3.0mol/L |
为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是
| |
物 质 |
除杂试剂 |
分离方法 |
| A |
硝酸铜溶液(硝酸银) |
铜粉 |
结晶 |
| B |
铜粉(铁粉) |
稀盐酸 |
过滤 |
| C |
乙醇(水) |
—— |
分液 |
| D |
NaCl溶液(CuCl2) |
NaOH溶液 |
萃取 |
月球的矿产资源极为丰富,仅月面表层5 cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石 [KAlSi3O8] 和橄榄石[(Mg或Fe)2SiO4]等,下列说法或分析不正确的是
| A.辉石、斜长石及橄榄石均属于硅酸盐矿 |
| B.橄榄石中铁为+2价 |
| C.月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 |
| D.斜长石的氧化物形式可表示为:K2O·Al2O3·3SiO2 |
两种金属组成的合金5.0g,与足量氯气反应,共用去0.1mol氯气,则该合金可能的组成是
| A.钙和铜 | B.锌和铜 | C.钠和铝 | D.铝和铁 |
下列可用来区别SO2和CO2气体的是
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾 ⑤氯化钡 ⑥品红溶液
| A.①④⑤⑥ | B.①②③⑥ | C.②③④⑤ | D.②③④⑥ |
在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为
| A.2:1 | B.1:2 | C.1:3 | D.1:4 |
近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为:
C + K2Cr2O7 + H2SO4(稀)—— CO2+ K2SO4+ Cr2(SO4)3+
(1)配平、完成上述反应的化学方程式,并用“单线桥法”表示电子转移情况 。
(2)此反应的氧化剂是 ,上述反应中若产生11g气体物质,则转移的电子数为 。
(3)H2SO4在上述反应中表现出来的性质是
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。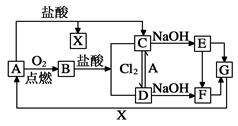
(1)写出A、C、F、G的化学式:A ,C ,F ,G 。
(2)检验D中阳离子的方法 。
(3)保存C溶液时为什么要加固体A 。
(4)写出下列转化的离子方程式C→D: 。
(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来。
①NaCl、KCl、NaClO、BaCl2 ②浊液、溶液、胶体、水
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为_______ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用 ml量筒;实验中还需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 ,若实验中出现下列现象,造成所配溶液浓度偏高的有 (填序号)
A.浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容
B.定容时仰视刻度线
C.量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)把2.0 mol/L CuSO4溶液和1.0 mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和)。向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时,溶液中的Fe2+物质的量浓度为 。
如图中,A是氯气的发生装置,B、C是净化气体的装置,B装置中装有饱和食盐水,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置。
(1)上述装置中有一处错误,请指出是 处(用字母表示)。
(2)B装置的作用是 ,C装置中需要加入 。
(3)写出A中发生反应的离子方程式 ,写出D中发生反应的化学方程式 。
(4)如果A中产生氯气3.36L(标准状况),请计算:被氧化的HCl的物质的量 。
(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是 。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是 。(填序号)
①NaAlO2 ②Ca(OH)2 ③Na2CO3 ④Al(OH)3 ⑤NaHCO3 ⑥Si
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是 ;过一会儿,溶液颜色逐渐褪去,起作用的成分是 ;
(4)已知:Fe2+的还原性强于Br—,标准状况下把11.2L氯气通入500ml 0.8mol/L FeBr2溶液中,写出反应完全后的离子方程式 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号