实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.Cl2O3 | D.ClO2 |
某污水中含CN-a mg·L-1,现用ClO2将CN-氧化,只生成两种无毒气体。处理100 m3这种污水,至少需要ClO2的物质的量为
| A.50a/13 mol | B.50a/26 mol | C.25a/13 mol | D.100a/13 mol |
已知溶液中:还原性: -氧化性
-氧化性 在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
| A.a点时NaHSO3过量 |
| B.b点时还原产物为碘离子 |
| C.b点到c点,KIO3与NaHSO3反应生成单质碘 |
| D.加入的KIO3为0.4mol或1.12mol时,反应后溶液中碘离子均为0.4mol |
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子其物质的量(mol)与反应时间t(min)的关系曲线.下列说法错误的是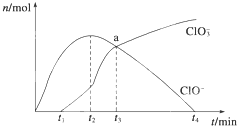
| A.参加反应所需NaOH与氯气的物质的量之比一定为2:1 |
| B.a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1 |
| C.t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-=2Cl-+ClO3- |
| D.使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是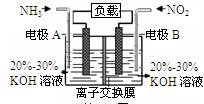
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.A电极上发生氧化反应,B为正极 |
| C.电极A极反应式为2NH3-6e-=N2+6H+ |
| D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol |
9.下列实验现象及相关的离子方程式均正确的是
| A.Cl2与FeI2溶液反应,当n(C12):n(FeI2)=1:1时:2Fe2++2I-+2C12 |
| B.向Ba(NO3)2溶液中通人SO2气体,出现白色沉淀:Ba2++SO2+ H2O |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2 MnO4+7 H2 O2+6 H+ |
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO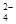 +H++OH- +H++OH- |
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为V2+-e-====V3+,下列说法正确的是
| A.放电时,右槽发生还原反应 |
| B.放电时,左槽电解液pH升高 |
| C.充电时,阴极的电极反应式:VO2++2H++e-====VO2++H2O |
| D.充电时,每转移1 mol电子,n(H+)的变化量为1 mol |
0.3molSO32-恰好将0.2molXO4-离子还原,则X元素在还原产物中的化合价是( )
| A.+1 | B.+2 | C.+3 | D.+4 |
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)氯碱厂获得Cl2的离子方程式为
| |
TiCl4 |
Mg |
MgCl2 |
Ti |
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。
已知FeS2与某浓度的HNO3反应时生成Fe(NO3) 3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:8,则该反应的还原产物是
| A.NO2 | B.NO | C.N2O | D.NH4NO3 |
造纸工业中常用Cl2漂白纸浆,漂白后的纸浆用NaHSO3除去残留的Cl2,其反应为:Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl,在这个反应中,氧化产物与还原产物的物质的量之比为
| A.2︰3 | B.3︰1 | C.2︰1 | D.1︰2 |
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是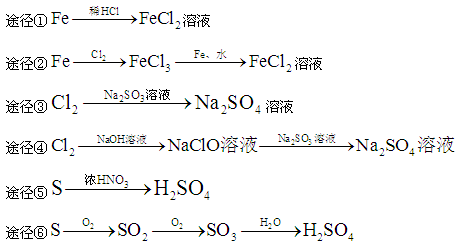
| A.由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- |
| B.由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C.由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D.以上说法都不正确 |
已知酸性高锰酸钾溶液可以将FeSO4氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是
| A.方程式中的X为2MnSO4 |
| B.氧化性:KMnO4>Fe3+>I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol |
| D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-===2Fe2++I2 |
现有一定量的铁粉和铜粉的混合物,将其平均分成四份,分别加入同浓度不同体积的稀硝酸,充分反应后,在标准状况下生成NO的体积和剩余金属的质量如表所示(假设硝酸的还原产物只有NO一种)。根据上表中的数据计算分析,下列推断正确的是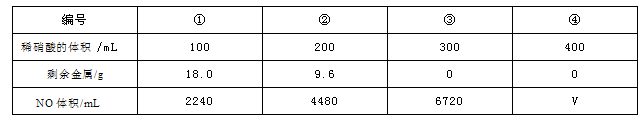
| A.①中溶解了5.6gFe | B.②中溶解了9.6gCu |
| C.硝酸的物质的量浓度为4 mol•L-1 | D.④中V=6720 |