磁性氧化铁(Fe3O4)可用于制造录音磁带和电讯器材,其溶于稀硝酸的化学方程式为:
3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O。
(1)Fe3O4晶体的颜色为______________。
(2)Fe(NO3)2在水溶液中的电离方程式为________________________。
(3)上述反应中,氧化剂是_____________(填化学式),被还原的氮元素与未被还原的氮元素的物质的量之比为_________,每生成2.24L(标准状况下)NO时,转移电子的物质的量为____________mol。
用铜屑制取硫酸铜溶液的一种方法是:将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气,其反应原理为2Cu+O2+2H2SO4="=" 2CuSO4+2H2O。其中,还原剂是__________(填化学式),被还原的物质是__________(填化学式),若制备时用2 mol Cu与足量的O2和H2SO4反应,可制得_________mol CuSO4 。
向VmLFeBr2溶液中缓慢通入amolCl2,结果溶液中有50%的Br-被氧化为溴单质,则原FeBr2溶液的物质的量浓度为
A.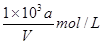 |
B.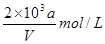 |
C.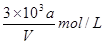 |
D.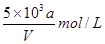 |
向100mL由等物质的量的FeBr2和FeI2配成的混合溶液中,缓慢通入氯气3.36L(标准状况),反应完全后,溶液中有一半的 Fe2+被氧化成Fe3+,则原混合液中FeI2的物质的量溶度为( )
| A.0.5 moL·L-1 | B.1.0 moL ·L-1 | C.1.2 moL ·L-1 | D.1.5 moL·L-1 |
浓度为0.05 mol·L-1的Na2SO3溶液24 mL恰好能被20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液氧化为Na2SO4,则K2Cr2O7被还原后得到的产物中Cr元素的化合价为( )
| A.+5 | B.+4 | C.+3 | D.+2 |
在反应 3S+6KOH=K2SO3+2K2S+3H2O中,还原剂和氧化剂的物质的量为: ( )
| A.1 :1 | B.2 :1 | C.1 :2 | D.3 :2 |
一定条件下硝酸铵受热分解的化学反应方程式为:5NH4NO3 = 2HNO3 + 4N2 + 9H2O,在反应中被还原与被氧化的氮原子数之比为
| A.5:3 | B.4:5 | C.5:4 | D.3:5 |
工业上制取金刚砂的化学方程式如下:SiO2+3C=SiC+2CO↑。在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为
| A.1︰2 | B.2︰1 | C.5︰3 | D.3︰5 |
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是 ( )
| A.Cu与Cu2O 的物质的量之比为2:1 |
| B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O, 若产生的氯气在标准状况下的体积为11.2L。试计算:
MnCl2+Cl2↑+2H2O, 若产生的氯气在标准状况下的体积为11.2L。试计算:
(1)参加反应的MnO2的质量。(2分)
(2)反应中被氧化的HCl的物质的量。
化合物KaFeb(C2O4)c·dH2O(其中铁为正三价)是重要的光化学试剂。通过下述实验确定该晶体的组成。
步骤a:称取该样品4.91g溶于水中配成250mL溶液,取出25mL溶液,向其中加入过量的NaOH溶液,将沉淀过滤,洗涤,高温灼烧至质量不再改变,称量其固体的质量为0.08g。
步骤b:另取出25mL溶液,加入适量稀H2SO4溶液,用0.050 mol·L-1KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液24.00mL。
已知: KMnO4+ H2C2O4+ H2SO4= MnSO4+ K2SO4+ CO2+ H2O
(1) 配平上述反应方程式
(2) 草酸为二元弱酸,其一级电离的方程式为 。
(3)滴定终点观察到的现象为 。
(4)通过计算确定样品的组成(写出计算过程)。
现将1mo1Cu2S与144g FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为
| A.4 mo1 | B.5 mo1 | C.6 mo1 | D.7 mo1 |
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )

| A.图中AB段的氧化剂为K2Cr2O7 |
| B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C.开始加入的K2Cr2O7为0.25mol |
| D.开始加入的K2Cr2O7与FeSO4的物质的量比为1:3 |
已知RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,0.2molRxO42-参加反应,共转移0.4mol电子,则x为()
| A.2 | B.3 | C.4 | D.5 |