1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
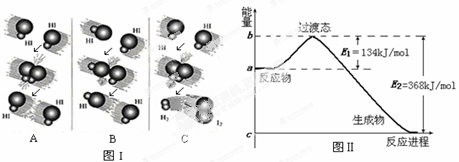
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是_____________(选填“A”、“B”或“C”);
(2)图II是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,则写出该反应的热化学方程式_______________________
(3)E1的大小对该反应的反应热有无影响? 。(选填“有”或“无”)
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键
|
C-H
|
Cl-Cl
|
C—Cl
|
H—Cl
|
键能/ kJ·mol–1
|
X
|
243
|
330
|
432
|
已知:反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H= -106kJ/mol,则上表中X= 。
(5)已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH=____________________


 粤公网安备 44130202000953号
粤公网安备 44130202000953号