研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
24mL浓度为0.05mol・L﹣1的Na2SO3溶液,恰好与20mL浓度为0.02mol・L﹣1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
| A.+2 | B.+3 | C.+4 | D.+5 |
将0.15molFe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
已知适当条件下+7、+6、+4价锰的化合物都能和浓盐酸反应制得氯气且还原产物都是MnCl2.将6.32g KMnO4粉末加热一段时间后收集到0.112L气体(标准状况,后同),冷却后放入足量的浓盐酸再加热,又收集到VL黄绿色气体,下列说法正确的是
| A.V=2.24L |
| B.参加反应的HCl为0. 18mol |
| C.无法确定最终生成含钾化合物的数量是多少 |
| D.6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2(标准状况) |
24mL0.05mol∙L-1的Na2SO3恰好与20mL0.02mol∙L-1的K2R2O7溶液完全反应,则R元素在还原产物中的化合价为
| A.0 | B.+2 | C.+3 | D.+6 |
磁性氧化铁(Fe3O4)可用于制造录音磁带和电讯器材,其溶于稀硝酸的化学方程式为:
3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O。
(1)Fe3O4晶体的颜色为______________。
(2)Fe(NO3)2在水溶液中的电离方程式为________________________。
(3)上述反应中,氧化剂是_____________(填化学式),被还原的氮元素与未被还原的氮元素的物质的量之比为_________,每生成2.24L(标准状况下)NO时,转移电子的物质的量为____________mol。
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。横、纵坐标的单位均为mol。
有关说法不正确的是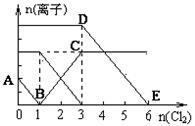
| A.线段BC代表Fe2+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=3 mol/L |
| C.原溶液中n (Fe2+): n (I-): n(Br-)=2:1:3 |
| D.当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题。
(1)运输氯气的钢瓶上应贴的标签为_____________。
| A.腐蚀品 | B.爆炸品 | C.有毒品 | D.易燃品 |
(2)工业上将氯气通入石灰乳制取漂白粉,写出该反应的化学方程式 。
(3)漂白粉的有效成分是(填化学式)_____________。
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2。高锰酸钾溶液常用于物质的定性检验与定量分析。某化学兴趣小组在实验室里欲用KMnO4固体来配制500 mL 0.1mol/L的KMnO4溶液。
①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、 。
②下列操作会导致实验结果偏小的是 (填字母)。
a.转移时没有洗涤烧杯、玻璃棒
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.加水定容时俯视刻度线
③用配好的该浓度的KMnO4溶液与300mL 0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为 mL。(已知MnO4-在此条件被还原为Mn2+)
(5)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量,已知:Cl2 + 2Br-=2Cl-+ Br2)。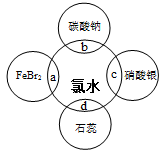
①能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”),现象是 。
②a中发生反应的离子方程式是 。
氯碱工业生产中用氨气检查氯气管道是否泄漏,氨气遇到氯气会产生白烟,
(1)反应还生成了一种无毒的气态单质,写出反应的化学方程式 ________________________。
(2)在该反应中,氧化剂是____________,还原产物是____________,当有1.7g的氨气参与反应时,转移的电子数目为____________。
(3)列式计算当有112 mL的氯气(已折算到标准状况)参加反应时生成白烟的质量为________ g。
用铜屑制取硫酸铜溶液的一种方法是:将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气,其反应原理为2Cu+O2+2H2SO4="=" 2CuSO4+2H2O。其中,还原剂是__________(填化学式),被还原的物质是__________(填化学式),若制备时用2 mol Cu与足量的O2和H2SO4反应,可制得_________mol CuSO4 。
碘化钾溶液久置于空气中,发生如下反应:
______KI+______O2+______H2O=______I2+______KOH
(1)在______上填上正确的化学计量数并用双线桥法标出电子转移的方向和数目;
(2)在该反应中,还原产物是________(填化学式);
(3)当有0.2mol电子发生转移时,生成I2的质量为________g。
0.3molSO32-恰好将0.2molXO4-离子还原,则X元素在还原产物中的化合价是()
| A.+1 | B.+2 | C.+3 | D.+4 |
危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3 =4N2 ↑+ 2HNO3 + 9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:_________________________________。
向VmLFeBr2溶液中缓慢通入amolCl2,结果溶液中有50%的Br-被氧化为溴单质,则原FeBr2溶液的物质的量浓度为
A.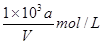 |
B.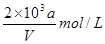 |
C.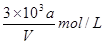 |
D.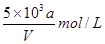 |