反应 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O中,氧化剂与还原剂的质量之比是
| A.1︰1 | B.1︰5 | C.5︰1 | D.3︰2 |
4 mL 0.5 mol/L的某KXO4溶液恰好能将160 mL 0.1 mol/L的FeSO4的酸性溶液反应完全,则X元素在还原产物中的化合价为
| A.-1 | B.0 | C.+2 | D.+3 |
已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气。得到的二氧化氮与氧气通入水中,恰好被水完全吸收,试分析该硝酸盐分解时金属化合价的变化情况是( )
| A.升高 | B.降低 | C.不变 | D.不能确定 |
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
| A.1/5 mol | B.2/5 mol | C.3/5mol | D.11/5 mol |
已知2Fe2++Br2=2Fe3++2Br-。向100mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
| A.2 mol/L | B.1 mol/L | C.0.4 mol/L | D.0.2 mol/L |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是: ( )
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
在反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为( )
| A.8 mol | B.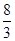 mol mol |
C.2 mol | D.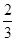 mol mol |
下列反应中,氧化剂与还原剂的物质的量之比为2 :1 的是( )
| A.Cu +2 H2SO4(浓) = CuSO4 + SO2↑+ 2H2O | B.2Na + H2SO4 = Na2 SO4 + H2↑ |
| C.3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O | D.2Na + Cl2 = 2NaCl |
已知A2On2-可与B2-反应,B2-被氧化,产物为B单质,A2On2-被还原,产物为A3+;且知100mL c(A2On2-)=0.3mol/L的溶液与150mL c(B2-)="0." 6mol/L的溶液恰好完全反应,则n值为[ ]
| A.4 | B.5 | C.6 | D.7 |
用0.1 mol/L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是( )
| A.+4 | B.+3 | C.+2 | D.+1 |
24mL浓度为0.05mol·L-1 Na2SO3溶液恰好与20mL 浓度为0.02mol·L-1的K2X2O7溶液完全反应,已知Na2SO3可被K2X2O7氧化为Na2SO4,则元素X在还原产物中的化合价为下列的
| A.+2 价 | B.+3 价 | C.+4价 | D.+5价 |
下列反应中,不属于氧化还原反应的是( )
| A.2FeCl3 + Fe = 3FeCl2 |
| B.2NaOH + Cl2 =" NaCl" + NaClO + H2O |
| C.Na2O + H2O = 2NaOH |
| D.CuSO4 + Fe = FsSO4 + Cu |