验室常用浓盐酸与二氧化锰反应来制取氯气,反应的化学方程式4HCl+MnO2="=" MnCl2+2H2O+Cl2↑现用密度为1.1 9g/cm3、质量分数为36.5%的浓盐酸与二氧化锰反应,生成的氯气在标准状况下的体积为5.6L。计算:
(1)浓盐酸中HCl的物质的量浓度。
(2)需要消耗二氧化锰多少克?
(3)被氧化的HCl的物质的量是多少?
实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平)KClO3+HCl——HCl+Cl2↑+H2O
(1)配平上述反应化学方程式:
KClO3+ HCl—— KCl+ Cl2↑+ H2O
(2)若产生0.1mol Cl2,则转移电子的物质的量为 mol。
(3)若反应中HCl的的利用率只有50%,当氧化产物比还原子能产物多7.1g时,求浓盐
酸的物质的量浓度。
R2O8 n- 在一定条件下可以把Mn2+氧化成MnO4-,若反应后R2O8n-变为RO42-,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是
| A.1 | B.2 | C.3 | D.4 |
在反应Fe3O4 +4CO 3Fe+4CO2中,
3Fe+4CO2中,
是氧化剂, 元素被氧化,氧化产物和还原产物的物质的量之比为 ,若生成的CO2在标准状况下为8.96L,则该反应中转移电子为 mol。
24 mL浓度为0.05 mol·L-1的Na2SO3溶液,恰好与20 mL浓度为 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应,则元素Cr在被还原产物中的化合价为
| A.+6价 | B.+3价 |
| C.+2价 | D.0价 |
在2KMnO4+16HBr====5Br2+2MnBr2+2KBr+8H2O反应中,若消耗1 mol氧化剂,则被氧化的还原剂的物质的量是_______________mol。
已知KClO3和KCl在H2SO4溶液中发生氧化还原反应,生成硫酸盐、氯气和水。完成下列问题:
(1)试写出该反应的离子方程式。
(2)若用K35ClO3与K37Cl反应,则生成的Cl2的相对分子质量为多少?
为测定一种复合氧化物型的磁性粉末材料的组成,称取12.52 g样品,将其全部溶于过量稀硝酸后,配成100.00 mL溶液,取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤,烘干后得4.66 g固体.在余下的50.00 mL溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。则:
(1)磁性粉末材料中氧元素的质量分数是__________。
(2)该磁性材料的化学式为__________。
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2 → H2O IO3- → I2 MnO4-→ Mn2+ HNO3→ NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
| A.H2O2 | B.IO3- | C.MnO4- | D.HNO3 |
【3分】在水溶液中离子可以将Fe3+还原成Fe2+,本身被氧化成Y,反应可简单表示为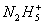 +4Fe3+
+4Fe3+ 4Fe2++Y+……,据此可知Y为( )
4Fe2++Y+……,据此可知Y为( )
A.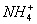 |
B.N2 | C.N2O | D.N2H4 |
【3分】硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25 mL 0.1 mol·L-1该溶液恰好把标准状况下的224 mL氯气完全还原,则产物中硫元素的化合价为( )
| A.-2 | B.0 | C.+4 | D.+6 |
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化磷的物质的量是( )
| A.2/5 mol | B.1/5 mol | C.11/5 mol | D.1/3 mol |