硫酸铵[(NH4)2SO4]在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是:( )
| A.1∶3 | B.2∶3 | C.1∶1 | D.4∶3 |
在强酸性溶液中可发生如下反应: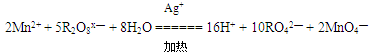
这个反应可定性地检验Mn2+ 的存在。在反应中充当氧化剂的R2O8 x— 中x的值是:( )
| A.0 | B.1 | C.2 | D.3 |
长期以来,人们一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰末获得HFO以来,对HFO的研究引起了充分重视。
(1)HFO的化学名称为
(2)HFO能与水发生反应:HFO+H2O=HF+H2O2,其中氧化剂是 ;
(3)写出F2与水发生发应的化学方程式,并用双线桥法标出该反应中电子转移的方向和数目:
10mL 0.05mol/L含有R2O72-离子的浓溶液恰好能将10mL 0.05mol/L的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为 ( )
| A.+1价 | B.+2价 | C.+3价 | D.+6价 |
对于反应2KMnO4+16HCl 2KCl+2MNCl2+5Cl2↑+8H2O,若有0.1molKMnO4参加反应,下列说法正确的是 ( )
| A.还原剂是KMnO4 | B.生成Cl2 5.6L |
| C.参加反应HCl为16mol | D.其转移电子0.5mol |
(1)配平下列化学反应方程式
Cu2S + HNO3—— Cu(NO3)2 + H2SO4 + NO + H2O
(2)标出电子转移的方向和数目。
(3)在标准状况下生成2.24LNO时,转移电子物质的量为 。
在化学反应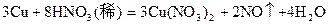 中,当有1.5摩铜被氧化时 ( )
中,当有1.5摩铜被氧化时 ( )
| A.有4mol硝酸被还原 | B.有1mol硝酸被还原 |
| C.转移6mol电子 | D.转移3mol电子 |
在3NO2+H2O=2HNO3+NO中,氧化剂与还原剂的分子个数比为
| A.2∶1 | B.1∶2 | C.3∶1 | D.1∶3 |
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。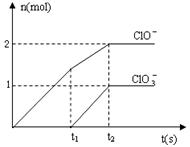
(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:____________ 。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若 ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
4.6 g Na与足量的水反应,反应中钠失去的电子数为 ( )
A 0.2 B 6.02 × 1023 C 1.204 × 1023 D 0.1 mol
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-现有16.8g铁和0.3molBr2反应后加入适量水后,通入amolCl2。
①.当a≤0.15时,反应离子方程式为
②.当Fe2+与Br-同时被氧化时,a的取值范围为
③.当a=0.3时,反应后氧化产物与还原产物的物质的量之比为 比
铁氧体(Fe3O4)法是处理含铬废水的常用方法。其原理是用FeSO4把废水中Cr2O72-离子还原为Cr3+离子,并通过调节废水pH,使生成物组成符合类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物 ·
· 。若处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O,则
。若处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O,则
| A.x=1,y=4,z=6 | B.x=0.5,y=1.5,z=8.5 |
| C.x=2,y=4,z=6 | D.x=2,y=6,z=4 |
新型无机非金属材料氮化硅是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特点,工业上可用下列方法制取:3SiO2+6C+2N2=Si3N4+6CO下列叙述正确的是( )
| A.Si3N4不与任何酸反应 |
| B.Si3N4中硅元素显-4价,氮元素显+3价 |
| C.Si3N4含有离子键 |
| D.上述反应,每生成1mol Si3N4,电子转移12mol |
(NH4) 2PtCl6晶体受热分解 , 生成氮气、氯化氢、氯化铵和金属铂。在此分解反应中 , 氧化产物与还原产物的物质的量之比是:
| A.1: 2 | B.1: 3 | C.2: 3 | D.3: 2 |
某一反应体系中有反应物和生成物共八种物质:KMnO4、SO2、CuS、H2SO4、CuSO4、K2SO4、MnSO4、H2O。反应中氧化过程如下:CuS→SO2。
(1)该反应中被还原的元素是___________,CuS发生氧化反应的实质是__________。
(2)若反应过程中转移了3 mol电子,则参加反应的CuS的物质的量为________mol。
(3)写出并配平该反应的化学方程式 ________________________________________。
(4)当KMnO4过量时,KMnO4会继续与SO2发生如下反应:
2KMnO4+5SO2+2H2O → 2H2SO4+K2SO4+2MnSO4
该反应中氧化产物与还原产物的物质的量之比为 _______。