上海市浦东新区高考预测化学卷
在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,下图中比较符合反应事实的曲线是
取m克铁粉与1 L 1.2 mol/L的稀HNO3恰好完全反应,反应后的溶液中只含Fe2+且硝酸的还原产物只有NO。则:
(1)m= g。
(2)若将反应后的溶液低温蒸干,析出晶体135 g,则析出晶体的组成可能是 。
(3)若向反应后的溶液中加入100 mL 1.5 mol/L的稀H2SO4,则标准状态下还能产生NO的体积为______L。
下列化学用语正确的是
A.锂离子的结构示意图: |
B.碳原子的轨道表示式: |
| C.丁烷的最简式:C2H5 | D.氯化镁的电子式: |
按系统命名法,下列有机物命名正确的是
A.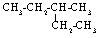 2-乙基丁烷 2-乙基丁烷 |
B.CH3-CHBr2二溴乙烷 |
C.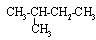 异丁烷 异丁烷 |
D. 4-甲基-2-戊烯 4-甲基-2-戊烯 |
下列有关晶体的说法正确的是
| A.分子晶体中一定不含离子键 | B.分子晶体中一定含有共价键 |
| C.离子晶体中一定只含离子键 | D.离子晶体的熔点一定比共价化合物高 |
铝元素是金属元素,某同学认为铝也有一定的非金属性。下列描述中,你认为能支持该同学观点的是
| A.铝片能与盐酸反应生成氢气 | B.氢氧化铝能溶于强碱溶液 |
| C.氯化铝溶液显酸性 | D.铝能发生铝热反应 |
下列各物质或微粒性质的比较中正确的是
| A.沸点:H2O>H2S>H2Se | B.热稳定性:H2CO3>NaHCO3>Na2CO3 | C.半径:Cl<Cl-<S2- | D.酸性:H2CO3<HNO3<H3PO4 |
已知石墨和金刚石燃烧的热化学方程式如下:
C(石墨,s)+O2(g) → CO2(g)+393.8 kJ ;C(金刚石,s)+O2(g) → CO2(g)+395.2 kJ
下列说法中正确的是
| A.石墨燃烧得到的CO2分子能量大于金刚石燃烧得到的CO2分子能量 |
| B.相同条件下,石墨比金刚石稳定 |
| C.等质量的石墨储存的能量大于金刚石 |
| D.石墨转化为金刚石是一个放热过程 |
下列有关原电池和电解池的叙述中正确的是
| A.钢铁腐蚀时,铁有时候作负极有时候作正极 |
| B.将铜片锌片用导线连接插入稀硫酸中,铜是阳极,铜片上有氢气产生 |
| C.用惰性电极电解氯化铜溶液时氯气在阳极产生 |
| D.电解氯化钠溶液时电子从负极经过溶液流向正极 |
下列有关过氧化钠的性质叙述错误的是
| A.性质活泼,易与多种物质反应 | B.具有很强的氧化性 |
| C.不稳定,受热易分解为氧化钠 | D.具有漂白性 |
双羟香豆素医学上用作抗凝剂,其结构如图所示。下列有关该物质的说法中正确的是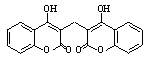
| A.分子式为C19H14O6 |
| B.遇FeCl3溶液能发生显色反应 |
| C.1 mol该物质最多能与10 mol氢气发生加成反应 |
| D.1 mol该物质最多能与含4 mol氢氧化钠的水溶液完全反应 |
某无色溶液中,能大量共存的离子组是
| A.K+、Na+、AlO2-、NO3- | B.K+、NH4+、CH3COO-、OH- |
| C.K+、NH4+、MnO4-、SO42- | D.Na+、Ag+、NO3-、Cl- |
下列对相关实验操作的说法中,一定正确的是
| A.酸碱中和滴定实验中只能用标准液滴定待测液 |
| B.测定硫酸铜晶体中结晶水含量时必须进行恒重操作 |
| C.实验室配制480 mL 0.1 mol/L NaOH溶液,需要准确称量NaOH 1.920 g |
| D.分液时,分液漏斗中下层液体从下口放出后,换一容器再从下口放出上层液体 |
设NA为阿伏加德罗常数,下列说法正确的是
| A.在标准状况下,22.4 L乙醇充分燃烧后生成气态产物的分子数为2NA |
| B.46 g NO2与足量水充分反应后,转移的电子数为NA |
| C.1 mol NH4+中含有11 NA个电子 |
| D.106 g无水Na2CO3固体中含有NA个CO32- |
向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图,则原混合溶液中MgCl2与FeCl3的物质的量之比为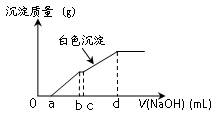
A.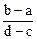 |
B.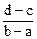 |
C.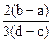 |
D.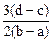 |
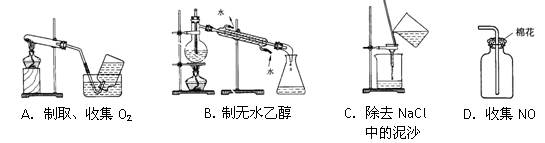
下列实验能达到目的的是
| A.用NaNO3固体与浓硫酸微热制HNO3 |
| B.通入CO2以除去Na2CO3溶液中混有的NaHCO3 |
| C.用AgNO3溶液来检验氯气中是否混有HCl气体 |
| D.用电流计、导线、烧杯及稀盐酸等用品来鉴别铁片和铝片 |
下列反应的离子方程式正确的是
| A.氯化铝溶液中滴入氨水:Al3++3OH-→ Al(OH)3↓ |
| B.硫酸铁溶液中通入硫化氢气体:2Fe3++3H2S → 2FeS↓+ S↓+ 6H+ |
C.苯酚钠溶液中通入二氧化碳气体: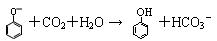 |
| D.NaHSO4溶液中滴入足量的Ba(OH)2溶液:H++SO42-+Ba2++OH-→ BaSO4↓+H2O |
将0.1 mol/L的HA溶液与0.1 mol/L的NaOH溶液等体积混合后,测得混合溶液pH=8,则溶液中有关微粒的浓度关系错误的是
A.c(HA)+c(A-)=c(Na+)=0.1mol/L
B.c(Na+)-c(A-)=c(OH-)-c(H+)
C.c(A-)>c(Na+)>c(OH-)>c(H+)
D.c(OH-)=c(H+)+c(HA)
将3.52 g CO2和SO2混合气体通入一定量的NaOH溶液中,气体全部与NaOH反应生成盐,将反应后的溶液减压低温蒸干后得到不含结晶水的固体,固体的质量可能为
| A.8.48 g | B.7.48 g | C.5.72 g | D.5.22g |
某一反应体系中有反应物和生成物共八种物质:KMnO4、SO2、CuS、H2SO4、CuSO4、K2SO4、MnSO4、H2O。反应中氧化过程如下:CuS→SO2。
(1)该反应中被还原的元素是___________,CuS发生氧化反应的实质是__________。
(2)若反应过程中转移了3 mol电子,则参加反应的CuS的物质的量为________mol。
(3)写出并配平该反应的化学方程式 ________________________________________。
(4)当KMnO4过量时,KMnO4会继续与SO2发生如下反应:
2KMnO4+5SO2+2H2O → 2H2SO4+K2SO4+2MnSO4
该反应中氧化产物与还原产物的物质的量之比为 _______。
现有部分短周期元素的性质或结构如下表:
| 元素编号 |
元素性质或结构 |
| X |
海水中质量分数最大的元素,其氢化物是最常用的溶剂 |
| Y |
地壳中含量最多的金属元素 |
| Z |
形成化合物最多的元素 |
| M |
短周期主族元素中原子半径最大的元素 |
(1)X原子中电子运动状态共有____种。Z元素最简单的气态氢化物分子的空间构型是___。
(2)写出Y元素最高价氧化物对应水化物的电离方程式____________。
(3)下列说法能证明M、Z、X三种元素形成的化合物属于离子化合物的是___________。
a.熔点比氯化钠高 b.水溶液能导电 c.液态时能导电 d.固体能导电
(4)与X同周期且非金属性强于X的元素是______(填元素名称),写出能说明这一事实的化学方程式___________。
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为____。
(2)根据右图写出该反应的化学方程式_______,该反应的平衡常数表达式为K=__________。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应是_____(填“放热”或“吸热”)反应,反应的平衡常数____(填“增大”、“减小”或“不变”。下同),B的反应速率______。若在第7分钟时增加D的物质的量,A的物质的量变化正确的是_____(用图中a~c的编号回答)
(4)某同学在学习了“化学反应速率和化学平衡”专题后,发表如下观点,你认为错误的是___。
a.化学反应速率理论是研究怎样在一定时间内快出产品
b.化学反应速率理论是研究怎样提高原料转化率
c.化学平衡理论是研究怎样使用有限原料多出产品
d.正确利用化学反应速率和化学平衡理论都可以提高化工生产的综合效益
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为 。
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
(1)称量样品所用的仪器为_____,将样品研细后再反应,其目的是_______。
(2)装置A的作用是________。
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)滴定时,标准碘溶液所耗体积为_________mL。判断滴定已达终点的现象是_______。
通过计算可知,该黄铜矿的纯度为________。
(5)若用如图装置替代上述实验装置d,同样可以达到实验目的的是____。(填编号)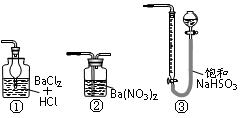
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有__________________________________________________。
二氧化碳和氢气按一定的体积比混合,在一定条件下可以制得烯烃,该技术已经成为节能减碳的有效途径之一。苯是一种重要的化工原料,下图是合成橡胶和TNT的路线。
回答问题:
(1)工业上由煤焦油提取苯的操作名称为__________。
(2)烯烃B的名称为________________;E的结构简式为__________________。
(3)写出反应类型:反应②________________;反应③____________________。
(4)写出反应①的化学方程式____________________________________。
(5)D在一定条件下与足量H2反应后的产物,其一氯代物有_________种。
丙烯是重要的化工原料,以丙烯为原料合成有机玻璃和油墨材料DAP-A树脂的流程如下:
回答问题:
(1)写出下列物质可能的结构简式:B___________________,F________________________。
(2)写出反应类型:反应②___________________;反应③____________________________。
(3)1 mol DAP-A树脂在一定条件下与H2发生加成反应,最多消耗H2_______________mol。
(4)写出反应①的化学方程式_____________________________________________________。
(5)写出G在一定条件下与乙二醇发生反应生成一种高分子化合物的化学方程式为_______。
(6)E的同分异构体中,属于酯类的链状有机物有 ___________________________________。
___________________________________。
工业上用含80% FeS2的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O2、盐酸反应):
4FeS2+11O2 2Fe2O3+8SO2 ①
2Fe2O3+8SO2 ①
FeS2+2HCl→ FeCl2+H2S↑+S↓ ②
2H2S+SO2→ 3S+2H2O ③
2NaOH+SO2→Na2SO3+H2O ④
Na2SO3+S Na2S2O3 ⑤
Na2S2O3 ⑤
通过分析上述反应,进行计算:
(1)若在某密闭容器中加入150 g上述硫铁矿,并通入10 mol含氧气体积分数为0.4的富氧空气,按反应①充分反应后得到的气体中SO2的体积分数为__________(计算结果保留3位小数)。
(2)若以上各步反应的转化率均为100%,则150 g上述硫铁矿理论上最多可制得Na2S2O3___ g。
(3)若NaOH溶液吸收SO2的吸收率为90%,其它反应的转化率均为100%,则150 g上述硫铁矿最多可制得Na2S2O3多少g(写出计算过程,计算结果保留1位小数)?
(4)若反应②、④的转化率为90%,其它反应的转化率均为100%,要制得Na2S2O3最多,则原料中FeS2在反应①和②中的理论质量配比为多少(写出计算过程,计算结果保留3位小数)?
 粤公网安备 44130202000953号
粤公网安备 44130202000953号