I.(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。(填字母)
A.C(s)+CO2(g)="2CO(g)" △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2CO(g)+O2(g)=2CO2(1) △H<0
(2)钢铁的电化学腐蚀原理,在酸性环境中发生析氢腐蚀,在中性或碱性环境中发生吸氧腐蚀。
①写出图1中石墨电极的电极反应式: 。
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在图1虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向。
II.电化学原理在化学工业中有广泛的应用.请根据如图回答问题:

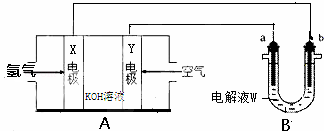
(1)装置A中的Y电极为 极,X电极的电极反应式为 ,工作一段时间后,电解液的PH将 (填“增大”、“减小”、“不变”)。
(2)若装置B中a为石墨电极、b为铁电极,W为饱和食盐水(滴有几滴酚酞),则铁电极的电极反应式为 。电解一段时间后若要恢复原溶液的成分和浓度,应该采用 的办法。
(3)若利用装置B进行铜的精炼,则a电极的材料为 ,工作一段时间后装置B电解液中c(Cu2+)将 (填“增大”、“减小”、“不变”).
(4)若装置B中a为Ag棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.16g,则流经电路的电子的物质的量为 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号