将1.92 g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到标况下气体1.12 L(设不含N2O4),求:
(1)收集到的气体中主要有含有 ;
(2)上述过程中,有关反应的化学方程式为 ; ;
(3)反应中被还原的HNO3的物质的量是 ;
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是多少摩尔?(计算过程)
钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可以求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
(1)配制5.0×10-3 mol·L-1KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
(2)每消耗草酸0.5mol,转移电子的物质的量为 mol;
(3)此人血液中的Ca2+的浓度为 mol·L-1。
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是
| A.该装置实现化学能向电能的转化 |
| B.该电池的总反应为2NO + O2 = 2NO2 |
| C.NiO电极的电极反应式: NO + O2- - 2e—= NO2 |
| D.当有2.24L的O2参与反应时,转移了0.4mole— |
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________。
(2)若电解质溶液为硫酸,其正极反应为______________________,
负极反应为___ ______________。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。计算:
①电解池阳极生成氯气的物质的量是 mol。
②氢氧燃料电池中转移的电子数目是 个
消耗H2的质量是 g。(写出计算过程)(保留2位小数)
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH— 2CO32— + 6H2O。则下列说法不正确的是
2CO32— + 6H2O。则下列说法不正确的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e—+8OH—=CO32— +6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
设阿伏加德罗常数为NA,下列说法正确的是
| A.用100ml 4mol/L盐酸与8.7gMnO2共热能制取氯气0.2NA |
| B.一定温度下0.1L 0.1mol/L的HA和1L0.01mol/L的HA所含A-微粒数均为0.01NA |
| C.在常温常压下,44g CO2与N2O的混合物中含有的原子总数为3 NA |
| D.1mol Cl2与足量的金属铝反应,转移电子数为3 NA |
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:
2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,据此,下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,据此,下列说法不正确的是
| A.KClO3发生还原反应 |
| B.H2C2O4在反应中被氧化 |
| C.H2C2O4的氧化性强于ClO2的氧化性 |
| D.每1 mol ClO2生成,该反应转移的电子数约为6.02×1023 |
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2SO4(s)能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:[N(CH3)4]2 SO4(s)+ SO2(g) [N(CH3)4]2 S2O6(s)下列说法正确的是
[N(CH3)4]2 S2O6(s)下列说法正确的是
| A.[N(CH3)4]+中只含共价键 |
| B.该反应中,SO2作氧化剂 |
| C.SO2漂白品红是利用其强氧化性 |
| D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6 |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关该反应的说法正确的是
| A.NF3分子中所有原子共平面 |
| B.NF3在反应中既做氧化剂又做还原剂 |
| C.生成0.2mol HNO3时转移0.2mol电子 |
| D.氧化产物与还原产物的物质的量之比为2∶1 |
1.92g电解铜片(纯铜)置于10mL14.2mol·L-1的浓硝酸中,铜片不断溶解,直至完全消失,反应中共收集到气体1.12L(标准状况)。假定反应前后溶液体积不变,且不考虑N2O4的存在。试求:
(1)反应后的溶液中硝酸铜的物质的量。
(2)反应后的溶液中硝酸的物质的量。
(3)反应产生的气体与一定量的氧气混合后,恰好能被足量的水完全吸收转化为硝酸,则所需氧气在标准状况下的体积为多少升?
(10分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2 6SO2+Fe3O4
6SO2+Fe3O4
该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:____________________________________。
(3)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为: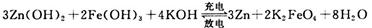
放电时电池的负极反应式为____________________;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
H2SO4和HNO3的浓度分别为4mol/L和2mol/L的混合液,取10mL加入过量的铁粉,若HNO3的还原产物为NO,则生成气体在标况下的总体积为
| A.0.224L | B.0.672L | C.0.112L | D.0.336L |
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应: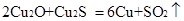 ,对于该反应,下列说法正确的是
,对于该反应,下列说法正确的是
| A.该反应的氧化剂只有Cu2O |
| B.Cu既是氧化产物又是还原产物 |
| C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol |
| D.该反应中氧化产物与还原产物的质量比为1∶6 |
已知反应:①Cl2 + 2KBr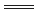 2KCl+Br2,②KClO3 +6HCl
2KCl+Br2,②KClO3 +6HCl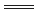 3Cl2+KCl +3H2O,
3Cl2+KCl +3H2O,
③2KBrO3 +Cl2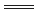 Br2 + 2KClO3,下列说法正确的是
Br2 + 2KClO3,下列说法正确的是
| A.上述三个反应都属于置换反应 |
| B.反应②中氧化剂与还原剂的物质的量之比为6∶1 |
| C.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| D.反应③中若有lmol还原剂反应,则氧化剂得到电子的物质的量为2mol |
设NA为阿伏加德罗常数的值,下列说法错误的是
| A.高温下,0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA; |
| B.MnO2与浓盐酸共热,0.4 molHCl被氧化时,转移电子数目为0.4 NA; |
| C.5.6g铁片投入足量浓H2SO4中,转移电子数目为0.3 NA; |
D.5NH4NO3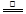 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA。 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA。 |