湖南省娄底市湘中名校高一上学期期末化学试卷
借助新的显微技术,能成功观察到小于200nm的粒子。下列分散系中,分散质粒子半径最小的是
| A.雾 | B.蛋白质溶液 | C.石灰乳 | D.硝酸钾溶液 |
下列反应中,必须加入氧化剂才能进行的是
| A.Cl2→ClO- | B.Zn→Zn2+ | C.Na2O2→O2 | D.CuO→CuCl2 |
下列物质不能通过化合反应制得的是
| A.FeCl3 | B.FeCl2 | C.Fe(OH)3 | D.Fe(OH)2 |
向含有下列离子的溶液中分别加入Na2O2(忽略溶液体积的变化),离子浓度基本不变的是
| A.AlO2- | B.Na+ | C.Fe2+ | D.HCO3- |
镁、铝和铜的混合物中依次加入过量盐酸、过量烧碱溶液并充分反应后,原混合物中金属的最终存在形式正确的是
| A.Mg2+ | B.Al3+ | C.AlO2- | D.Cu(OH)2 |
将含有氧化铁的铁片投入足量稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且溶液中的Fe2+与生成的H2的物质的量之比为4∶1,则原混合物中氧化铁与铁的物质的量之比为
| A.1∶1 | B.2∶5 | C.1∶2 | D.3∶1 |
能正确表示下列反应的离子方程式是
| A.Cl2通往NaOH溶液中:Cl2+OH-=Cl-+ClO-+H2O; |
| B.NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O; |
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2O; AlO2-+4NH4++2H2O; |
| D.Cu溶液于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。 |
某未知溶液可能含Cl―、CO32―、Na+、SO42―、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是①一定有Cl―,②一定有SO42―,③一定没有Al3+,④一定没有CO32―。
| A.①② | B.③④ | C.①③ | D.②④ |
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
| A.2Na2O2+CO2→2Na2CO3+O2; | B.2Na2O2+2SO3→2Na2SO4+O2; |
| C.Na2O2+H2SO4→Na2SO4+H2O2; | D.3Na2O2+Cr2O3→2Na2CrO4+Na2O |
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
| A.FeO | B.Fe2O3 | C.FeSO4 | D.Fe3O4 |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.氯水的颜色呈浅绿色,说明氯水中含有Cl2; |
| B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-; |
| C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+; |
| D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO。 |
下列叙述I和II均正确并有因果关系的是
| 选项 |
叙述I |
叙述II |
| A |
KNO3的溶解度大 |
用重结晶法除去KNO3中混有的NaCl |
| B |
BaSO4难溶于酸 |
用盐酸和BaCl2溶液检验SO42- |
| C |
NH3能使酚酞溶液变红 |
NH3可用于设计喷泉实验 |
| D |
Ca(OH)2能制成澄清石灰水 |
可配制2.0 mol∙L-1的Ca(OH)2溶液 |
下列有关物质应用的说法错误的是
| A.生石灰用作食品抗氧剂; | B.氢氧化铝用于制胃酸中和剂; |
| C.浓氨水可检验氯气管道泄漏; | D.氧化铁能用于制作红色涂料。 |
设NA为阿伏加德罗常数的值,下列说法错误的是
| A.高温下,0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA; |
| B.MnO2与浓盐酸共热,0.4 molHCl被氧化时,转移电子数目为0.4 NA; |
| C.5.6g铁片投入足量浓H2SO4中,转移电子数目为0.3 NA; |
D.5NH4NO3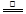 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA。 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA。 |
20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度= ,Ba2+的物质的量= 。
现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是 ,遇KSCN溶液显血红色的是 ,加铁粉后溶液增重的是 ;
(2)向③的溶液中滴加NaOH溶液,现象是 ,写出此步操作属于氧化还原反应的化学方程式 。
某溶液含Cl-、SO42-、CO32-三种阴离子,欲依次检验出此三种阴离子且只取用一次该溶液,则:
(1)最先检出的离子是 ,需加入稍过量的试剂是 (写化学式);
(2)最后检出的离子是 ,反应的离子方程式为 。
科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的的明确性。某学生用下图所示方法研究物质的性质,其中,气体A的主要成分是氯气(含有空气和水蒸气)。请回答下列问题: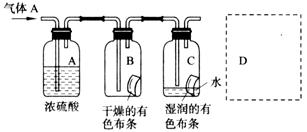
(1)该项研究(实验)的主要目的是 ;
(2)浓硫酸的作用是 _ ;
(3)与研究目的直接相关的实验现象是: 。
(6分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。
(1)装置I中产生气体的化学方程式为: ;
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 ;
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
X、Y、Z、W四种化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)W的化学式是 ;
(2)X与Y在溶液中反应的离子方程式是: ;
(3) 中反应的化学方程式是: 。
中反应的化学方程式是: 。
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用,在实验室,浓硫酸是常用的干燥剂。
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度= mol·L-1;
(2)若以浓硫酸吸水后生成H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收水的质量= 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号