关于10mL0.1 mol.·L-1的NH3 • H2O溶液,下列说法正确的是
| A.25°C时,若溶液的 pH=11,则 Kb(NH3 • H2O) = 1X10-6 mol.L-1 |
B.向溶液中加入少量CH3COONa固体,溶液中 的值变小 的值变小 |
| C.向溶液中加入10mL 0.1 mol.L-1HC1,所得溶液中离子浓度大小顺序为C(NH4+)>C(Cl-)>C(H+)>C(OH-) |
| D.向溶液中加入5mL0.1mol/LHC1,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
下列溶液中各微粒的浓度关系正确的是
A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+)
B.将10 mL 0.1 mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)= c(HCO3-)+c(CO32-)
D.0.2 mol·L-1的某一元弱酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后的溶液:2c(OH一)+c(A一)=2c(H+)+c(HA)
对于常温下pH为2的盐酸,叙述正确的是
| A.溶液中c(H+)=c(Cl—) |
| B.与等体积pH=12的氨水混合后所得溶液显酸性 |
| C.由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍 |
| D.与等体积0.01 moI·L-1碳酸钠溶液混合后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
下列溶液中有关物质的量浓度关系正确的是
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-) >c(H+)> c(OH-)
B.pH 相等的CH3COONa 和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)= c(A-)
D.0.1 mol·L-1的NaHA 溶液 pH=l:c(Na+)= c(H2A) + c(HA-) + c(A2-)
25℃时,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和20.00 mL 0.100 mol/L醋酸(忽略温度变化)。下列说法正确的是
| A.滴定前,盐酸和醋酸溶液中:c(Cl‾)<c(CH3COO—) |
B.分别加入10.00 mL NaOH溶液时,测得醋酸反应后所得溶液pH=6,则溶液中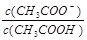 >1 >1 |
| C.当两种溶液的pH均等于7时,两种酸所消耗NaOH溶液体积不相等,醋酸消耗的NaOH溶液体积多 |
| D.加入20.00 mL NaOH溶液时,所得两种溶液中:c(Cl‾)<c(CH3COO—) |
室温下,向20mL a mol·L-1CH3COOH溶液中逐滴加入0.1mol·L-1 NaOH溶液,其pH变化曲线如图所示。下列说法中,正确的是
| A.a=1×10-3 |
| B.V(NaOH)=200amL时,溶液中:c (Na+)= c(CH3COO-)+ c(CH3COOH)=0.1mol·L-1 |
| C.该滴定实验使用甲基橙作指示剂 |
| D.d点之后的溶液中离子浓度大小关系可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
下列溶液中,有关物质的量浓度关系正确的是
A.室温下,向10 mL pH=3.0的醋酸溶液中加入水稀释后,溶液中 将要变小
将要变小
B.pH=8.0的KHS溶液中,c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c (A-)=2c(H+)+c(HA)
D.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(NH3·H2O)<c(HCl)
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下)。其中正确的是
①pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位
②1 L 0.50 mol·L-1 NH4Cl 溶液与2 L 0.25 mol·L-1 NH4Cl 溶液含NH4+ 物质的量前者大
③pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
④pH=4、浓度均为0.1mol·L-1 的CH3COOH、CH3COONa混合溶液中:
c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol/L
| A.①② | B.②③ | C.①③ | D.②④ |
现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成溶液。下列有关推断正确的是( )
A.若该溶液中HA电离能力大于A-水解能力,则有c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B.若该溶液中A-水解能力大于HA电离能力,则有c(A-)>c(HA)>(Na+)>c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的
| A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) |
| B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) |
| C.V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
| D.V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+) |
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是 ( )
| A.pH=5.2的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) |
| B.在滴加酚酞溶液的氨水中,加入NH4Cl溶液恰好无色,则此时溶液的pH﹤7 |
| C.Na2CO3溶液中,c(OH-)-c(H+)= c(HCO3-)+2 c(H2CO3) |
| D.pH=2的一元酸溶液与pH=12的NaOH溶液等体积混合,则溶液的pH一定不大于7 |
草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是( )
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c(C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液 ,pH=7,c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
下列溶液中各微粒的浓度关系正确的是
| A.物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液, c (NH4+)的大小顺序为:①>②>③ |
| B.pH相等的NaF与CH3COOK溶液:c(Na+)-c(F—)>c(K+)-c(CH3COO—) |
| C.0.2 mo1·L—1的Na2CO3溶液:c(OH—)=c(HCO3—)+c(H+)+2c(H2CO3) |
| D.0.2 mo1·L—1 HCl与0.1 mo1·L—1 NaAlO2溶液等体积混合:c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—) |
下列有关溶液的说法正确的是
A.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
B.物质的量浓度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中,c( )的大小关系:④>①>②>③
)的大小关系:④>①>②>③
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-)
D.物质的量浓度之比为1∶1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(CO32-)