湖北省武汉市武昌区高三元月调考理综化学试卷
下列说法不正确的是
| A.二氧化硅晶体是一种无色透明的固体,常用作光导纤维的材料 |
| B.臭氧是一种有特殊臭味、氧化性极强的淡蓝色气体,可用作餐具的消毒剂 |
| C.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸、碱的腐蚀 |
| D.人造纤维可利用竹子、棉花、麻类的纤维材料制成,而合成纤维是利用自然界的非纤维材料(如石油、煤)通过化学合成方法得到 |
某有机物的结构简式为 。下列关于该有机物的叙述正确的是
。下列关于该有机物的叙述正确的是
| A.该有机物属于芳香烃 |
| B.该有机物苯环上一氯代物有6种 |
| C.该有机物可发生取代、加成、加聚、消去反应 |
| D.1 mol该有机物在适当条件下,最多可与3 mol Br2、5 mol H2反应 |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是
| A.上述实验条件下,物质的氧化性:Cu2+ > I2 > SO2 |
| B.通入SO2时,SO2与I2反应,I2作还原剂 |
| C.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| D.滴加KI溶液时,转移2 mol e-时生成1 mol白色沉淀 |
X、Y、Z、W为原子序数依次增大的短周期元素。其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构。下列说法正确的是
| A.X、Y、Z、W的原子半径的大小关系为:W > Y > Z > X |
| B.在Y2X2、Z2X4、X2W2的一个分子中,所含的共用电子对数相等 |
| C.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物 |
| D.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 |
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下)。其中正确的是
①pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位
②1 L 0.50 mol·L-1 NH4Cl 溶液与2 L 0.25 mol·L-1 NH4Cl 溶液含NH4+ 物质的量前者大
③pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
④pH=4、浓度均为0.1mol·L-1 的CH3COOH、CH3COONa混合溶液中:
c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol/L
| A.①② | B.②③ | C.①③ | D.②④ |
下列实验操作与安全事故处理错误的是
| A.用试管夹从试管底由下往上夹住距离管口约三分之一处,手持试管夹长柄末端,进行加热 |
| B.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
| C.把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中 |
| D.实验时不慎打破温度计水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 |
25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为
| A.1.8×10-7mol/L | B.1.8×10-8 mol/L | C.1.8×10-9mol/L | D.1.8×10-10mol/L |
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,溶液的pH= 。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为 ,由水电离出的c(OH-)= mol·L-1。
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则HX是 (填“强酸”或“弱酸”),理由是 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为 (填化学式)。
②25 ℃时,在0.5 mol/L 的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的 倍。
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体。实验室合成三苯甲醇的实验装置如图所示。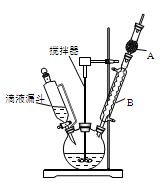
已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
| 物质 |
沸点/℃ |
| 三苯甲醇 |
380 |
| 乙醚 |
34.6 |
| 溴苯 |
156.2 |
③三苯甲醇的相对分子质量为260。
请回答下列问题:
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:
其中,操作①的名称是 ;洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。
开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。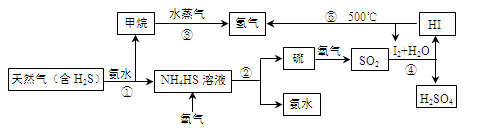
回答下列问题:
(1)反应②的化学方程式为 。
(2)反应④的离子方程式为 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 (填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为 。
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00 m3天然气理论上可制得氢气 m3(同温同压条件下)。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物)。
①生成目标产物的电极反应式为 。
②该储氢装置的电流效率为η= 。(η=  ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)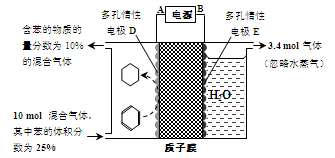
【化学——选修2:化学与技术】海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用 (写一点即可)。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
【化学——选修3:物质结构与性质】过渡金属元素铁能形成多种配合物,如:K3[Fe(SCN)6][硫氰合铁(Ⅲ)酸钾]和Fe(CO)x等。
(1)①基态Fe3+的M层电子排布式为 。
②请解释+3价铁的化合物较+2价铁的化合物稳定的原因 。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x = 。
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为 。
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键。二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种。
①二茂铁的分子式为 。
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷。因此每个环含有 个π电子。
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8 ~ 20 kJ/mol。温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c。比较稳定的
是 结构(填“重叠”或“错位”)。

 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 。
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 。 粤公网安备 44130202000953号
粤公网安备 44130202000953号