[安徽]2013届安徽省黄山市高三第二次质量检测理综化学试卷
已知P单质在KOH溶液中的变化是:4P+3KOH+3H2O=3KH2PO2+PH3↑,下列说法正确的是
| A.产物PH3分子中所有的原子可能共平面 |
| B.该反应中P做还原剂,H2O做氧化剂 |
| C.相关元素的第一电离能的大小顺序:S>P>Si |
| D.该反应每发生0.3摩尔电子转移,PH3分子中就有0.3摩尔P-H键形成 |
下列有关实验的叙述正确的是
| A.用水润湿的pH试纸来测量溶液的pH |
| B.实验室需要480 mL 2.0 mol·L-1的氢氧化钠溶液,配制该溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 |
| C.用溴水、淀粉-KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 |
| D.向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
室温下,下列各组离子、分子在指定溶液中一定能大量共存的是
| A.Na2S溶液中 SO42-、 K+、Br-、Cu2+ |
| B.在c(H+)=1.0×10-13mol·L-1的溶液中 Na+、S2-、AlO2-、SO32- |
| C.能使甲基橙显红色的溶液: K+、MnO4-、H2C2O4、SO42- |
| D.在 NH3·H2O 的溶液中Ba2+、NO3-、Cl-、Ag+ |
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi LixV2O5。下列说法正确的是
LixV2O5。下列说法正确的是
| A.该电池充电时,锂极与外电源的负极相连 |
| B.电池在放电时,Li+向负极移动 |
| C.该电池充电时阴极的反应为:LixV2O5 -xe-=V2O5 + xLi+ |
| D.若放电时转移0.2 mol 电子,则用去的锂为1.4 x g |
下列溶液中,有关物质的量浓度关系正确的是
A.室温下,向10 mL pH=3.0的醋酸溶液中加入水稀释后,溶液中 将要变小
将要变小
B.pH=8.0的KHS溶液中,c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c (A-)=2c(H+)+c(HA)
D.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(NH3·H2O)<c(HCl)
已知图一表示的是可逆反应CO(g)+H2(g)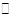 C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)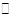 N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
| A.图一的t2时刻和和图二的t1时刻改变的条件都有可能是升高了温度或增大了压强 |
| B.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
| C.图一表示在新条件下达到平衡时,v′(正)>v′(逆),图二表示在新条件下达到平衡时,v′(正)<v′(逆) |
| D.其它条件不变,分别使用不同催化剂上述反应的平衡常数均不变 |
利用中学所学相关规律,下列推断正确的一项是
| A.碳酸钡的溶解度略大于硫酸钡,向硫酸钡的饱和溶液中加入较多的碳酸钠固体,会有碳酸钡生成 |
B.某温度T时,水的离子积常数为KW,该温度下将V1mLa mol•L-1的一元酸HA与V2mLb mol•L-1的一元碱BOH充分混合,若混合溶液中c(OH-)= mol•L-1,则此溶液不一定呈中性 mol•L-1,则此溶液不一定呈中性 |
| C.ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 |
D.依据反应2C+SiO2 2CO↑+Si ,还原性:Si <C 2CO↑+Si ,还原性:Si <C |
X、Y、Z、Q、T五种元素位于前四周期,且原子序数依次增大。X、Y的单质在常温常压下呈气态,X 形成的单质分子中无孤电子对,Y的基态原子中p能级上有两个未成对电子,Z原子的半径在同周期主族元素中最大, Q的氧化物是形成酸雨的一种主要物质,T2+所含有的电子数等于Z和Q原子的电子数之和。
(1)Q元素位于元素周期表第 周期 族,T2+的电子排布式为 。
(2)Y元素和Q元素分别形成的组成相似的氢化物中,沸点较高的是 (写化学式),原因是
用惰性电极电解X、Y、Z三种元素形成的化合物水溶液,其阳极的电极反应式为 。
(3)Z与Q形成的化合物的水溶液呈 填“酸性”、“中性”或“碱性”),原因
是 (用离子方程式表示)。
(4)已知在25℃、101325Pa时:
2T(s)+Q(s)=T2Q(s) △H=-79.5KJ/mol
Q(s)+Y2(g)=QY2(g) △H=-296.6KJ/mol
根据上述反应,请写出T2Q与Y2反应生成T与 QY2的热化学方程式 。
水杨酸己酯分子式为C13H18O3,具有花果香味,用作化妆品香料的定香剂,也用作烟草香精。它的一种同分异构体A具有如下转化关系:
已知:
①C分子中有一个碳原子连接着4个不同的原子或原子团,且1 molC和足量金属Na反应能产生0.5 mol H2
②F中除了含有1个苯环外,还含有1个五元环
(1)写出B的结构简式 ;写出G含有的官能团的名称
(2)写出A和NaOH溶液反应的化学方程式 ;
写出E发生银镜反应的化学方程式 ;
(3)B生成F的反应类型是 ;C生成D的反应类型是 ;
(4)化合物B有多种同分异构体,写出两种符合下列条件的同分异构体的结构简式:
a.属于芳香族化合物
b.酸性条件下能发生水解反应且其中一种产物的苯环上的一氯代物只有两种
c.1 mol该有机物最多可消耗3molNaOH
资料显示:在一定条件下黄铵铁钒在pH=0.5~2.5范围内均能稳定存在,工业上用酸浸法制取硫酸铜的流程示意图如下:
根据题意完成下列问题:
(1)步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
(2)在步骤(iii)发生的反应中,加入少量MnO2的作用是
(3)步骤(iv)除去杂质的离子方程式可表示为
(4)实验室模拟碱式碳酸铜[Cu2(OH)2CO3]的制备,向大试管中加入碳酸钠溶液和硫酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。根据上述碱式碳酸铜的制备方法,请完成以下问题:
①过滤后洗涤的目的是什么 ;简述如何洗涤沉淀
②若实验得到a g样品(只含CuO杂质),取此样品加热至分解完全后,得到b g固体,此样品中碱式碳酸铜的质量分数是
某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚的兴趣,试通过实验来探究其成分。
Ⅰ.实验装置:
用一氧化碳还原氧化铁的实验装置
该装置B中发生的离子方程式是
装置B的作用是
Ⅱ.实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ.实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,她增加了一个实验:用磁铁靠近生成的黑色固体,看到有黑色固体被磁铁吸引。于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们结论作出判断并通过实验检验其合理性:
(1)在一定条件下:一氧化碳与氧化铁在加热条件下,可发生如下反应
3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+4CO 4Fe+4CO2
4Fe+4CO2
(2)四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论: 你对此评价的理由是:
Ⅳ.实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中_______________________
为确定实验中最后的产物的成分,丙同学设计如下实验,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器: 1mol/LCuSO4 、0.01mol/L KSCN溶液、1mol/L盐酸、0.01mol/L氯水、试管、玻璃棒、胶头滴管。
| 实验操作 |
预期现象和结论 |
| 步骤一:取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/LCuSO4溶液、搅拌溶解。 |
(1)若A试管中黑色固体不溶解,并且没有观察到其他现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有Fe。 |
| 步骤二:对试管B中溶液过滤,将所得固体洗涤干净后,加足量1mol/L盐酸后,再依次分别加入适量0.01mol/L氯水、少量0.01mol/L KSCN溶液 |
(1)若溶液不变红色,则 (2)若溶液变红色,则 |
Ⅴ.延伸探究:丁同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应) (填“行”或“不行”)理由是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号