X、Y、Z、Q、T五种元素位于前四周期,且原子序数依次增大。X、Y的单质在常温常压下呈气态,X 形成的单质分子中无孤电子对,Y的基态原子中p能级上有两个未成对电子,Z原子的半径在同周期主族元素中最大, Q的氧化物是形成酸雨的一种主要物质,T2+所含有的电子数等于Z和Q原子的电子数之和。
(1)Q元素位于元素周期表第 周期 族,T2+的电子排布式为 。
(2)Y元素和Q元素分别形成的组成相似的氢化物中,沸点较高的是 (写化学式),原因是
用惰性电极电解X、Y、Z三种元素形成的化合物水溶液,其阳极的电极反应式为 。
(3)Z与Q形成的化合物的水溶液呈 填“酸性”、“中性”或“碱性”),原因
是 (用离子方程式表示)。
(4)已知在25℃、101325Pa时:
2T(s)+Q(s)=T2Q(s) △H=-79.5KJ/mol
Q(s)+Y2(g)=QY2(g) △H=-296.6KJ/mol
根据上述反应,请写出T2Q与Y2反应生成T与 QY2的热化学方程式 。

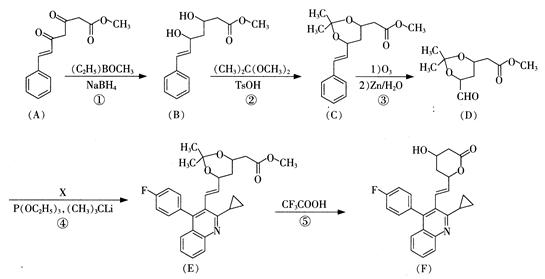
 ,再转化为F。你认为合成路线中设计步骤②的目的是 。
,再转化为F。你认为合成路线中设计步骤②的目的是 。 ,该反应原理在有机合成中具有广泛应用。试写出以
,该反应原理在有机合成中具有广泛应用。试写出以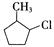 为主要原料制备
为主要原料制备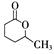 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: CH2=CH2
CH2=CH2 CH3CH3
CH3CH3



 (—R1、R2表示氢原子或烃基)
(—R1、R2表示氢原子或烃基)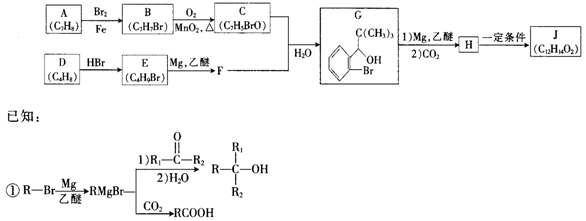
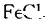 溶液发生显色反应的结构简式为 (写出一种即可)
溶液发生显色反应的结构简式为 (写出一种即可)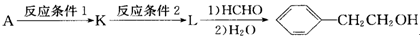
 粤公网安备 44130202000953号
粤公网安备 44130202000953号