常温下,有关醋酸溶液的叙述中错误的是
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COOˉ) |
| B.将pH=3的醋酸稀释为pH=4的过程中,c(CH3COOH)/ c(H+)比值不变 |
| C.浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后:c(CH3COOˉ)+ c(CH3COOH)="2" c(Na+) |
| D.amLpH=3的醋酸溶液与bmLpH=11的NaOH溶液恰好完全中和时,a=b |
常温下有0.1mol·L-1的NaHA溶液,其pH=9,下列说法正确的是( )
A.c(Na+)=c(HA-)+c(A2-)+c(H2A)
B.c(HA-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(HA-)>c(OH-)>c(H2A)
D.c(H+)+2c(H2A)= c(OH-) +c(A2-)
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)> c(OH-)>c(H+) |
下列关于pH=12的Na2CO3溶液说法正确的是
| A.升高溶液温度,溶液pH增大 |
| B.c(Na+) +c(H+)=c(CO32-)+ c(HCO3-)+ c(OH-) |
| C.溶液中c(OH-)>c(HCO3-)> c(H+) |
| D.2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) |
下列溶液中有关物质的浓度关系正确的是
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)> c[(NH4)2SO4]> c(NH4Cl) |
| B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
把0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,溶液显酸性,下列叙述正确的是
| A.c(CH3COO-)>c(Na+) |
| B.c(CH3COOH)> c(CH3COO-) |
| C.c(CH3COOH)+ c(CH3COO-)=0.1mol•L-1 |
| D.加入少量NaOH固体,c(Na+)增大而c(CH3COO-)减小 |
下列说法正确的是
A.等物质的量浓度的硫酸氢铵溶液和氢氧化钠溶液等体积混合:c(S042-)>c(Na+)>C(NH4+)>c(OH-)=c(H+)
B.常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系: c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-)
C.在滴有酚酞溶液的氨水中,加入NH4CI的溶液恰好无色,则此时溶液的PH<7
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,若混合液pH=7,则溶液中:2c(R2-)+c(HR-)=c(Na+)
下列有关电解质溶液中微粒的关系不正确的是
| A.25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.25℃时,pH=3的氯化铵溶液中: c(OH-)=1.0×10-11mol·L-1 |
| C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 |
| D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-) |
部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数(25 ℃) |
K1=1.77×10-4 |
K1=4.9×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是( )
A.2CN-+H2O+CO2 → 2HCN+CO32-
B.2HCOOH+CO32-→ 2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液pH前者小于后者
室温下,某浓度的醋酸溶液中n(CH3COO-)=0.01mol,下列叙述正确的是
| A.向该醋酸溶液中加入等体积等浓度的盐酸,抑制醋酸的电离,溶液中c(H+)增大 |
| B.若醋酸溶液体积为1L,则c(CH3COOH)=0.01mol/L |
| C.与NaOH恰好中和时,溶液中c(Na+)<c(CH3COO-) |
| D.与等体积等浓度的醋酸钠溶液混合,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-) |
下列说法正确的是( )
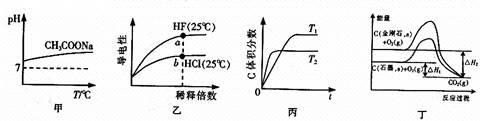
| A.由图甲可知,升高温度醋酸钠的水解程度增大 |
| B.由图乙可知,a点Kw的数值比b点Kw的数值大 |
C.由图丙可知,反应A(g)+B(g) 2C(g)是吸热反应 2C(g)是吸热反应 |
| D.由图丁可知,反应C(金刚石,s) = C(石墨,s)的焓变△H =△H1-△H2 |
对于常温下pH=3的乙酸溶液,下列说法正确的是( )
| A.c(H+)=c(CH3COO-) + c(OH-) |
| B.加水稀释到原体积的10倍后溶液pH变为4 |
| C.加入少量乙酸钠固体,溶液pH降低 |
| D.与等体积pH为11的NaOH溶液混合后所得溶液中:c(Na+)=c(CH3COO-) |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3-)+c(H+) |
| B.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1]:c(Na+) >c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
下列关于常温下电解质溶液的叙述中,正确的是
| A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O |
| B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+ c(NH4+)= c(Cl-)+ c(OH-) |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者 |
| D.25℃时,pH=8的0.1mol·L-1NaX溶液中由水电离出的c (OH-)=1×10-8mol·L-1 |
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
| A.亚氯酸钠在碱性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| C.使用该漂白剂的最佳pH为3 |
| D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有则c(HClO2)+ 2c(H+)=c(ClO2-)+ 2c(OH-) |