已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量, 产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
请回答:a点溶液中所含溶质的化学式为__________ ,b点溶液中各离子浓度由大到小的关系是_________________________________。
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号F火箭的燃料是液态偏二甲肼(CH3-NH-NH-CH3),氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
(2)298 K时,在2L的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
①298k时,该反应的平衡常数为________ L ·mol-1。
②下列事实能判断该反应处于平衡状态的是
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c. V(N2O4)正=2V(NO2)逆
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时
V(正) V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常
数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序
是__________。
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3−=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。 a.c(Na+)= c(H2S)+c(HS−)+2c(S2−)
a.c(Na+)= c(H2S)+c(HS−)+2c(S2−)
b.2c(Na+)=c(H2S)+c(HS−)+c(S2−)
c.c(Na+)=3[c(H2S)+c(HS−)+c(S2−)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为  (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用NaOH溶液或Fe2(SO4)3溶液吸收多余的SO2气体。
(1)用NaOH溶液吸收多余的SO2气体,若两者恰好反应生成Na2SO3溶液,则Na2SO3溶液中各微粒间浓度关系正确的是_______。
| A.c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) |
| B.c(Na+)=2c(SO32-) + 2c(HSO3-) + 2c(H2SO3) |
| C.c(Na+) + c(H+)=2c(SO32-) + c(HSO3-) + c(OH-) |
| D.c(H+) + c(HSO3-) + 2c(H2SO3)=c(OH-) |
(2)用Fe2(SO4)3溶液吸收多余的SO2气体,写出SO2与Fe2(SO4)3溶液反应的离子方程式__________
(3)用Fe2(SO4)3溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量 的OH-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-;
假设2:还存在Fe3+;
假设3:___________________
……
②设计实验方案
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量吸收液于试管中,加稀硫酸酸化,然后再滴入几滴品红溶液; |
现象:________________________________ 结论:假设1不成立; |
| 步骤2:______________________________ ____________________________________。 |
现象:________________________________ 结论:假设2成立。 |
研究表面,可用NaBH4与水反应制氢氧燃料电池的氢气:BH4-+2H2O=BO2-+4H2↑(实质为水电离产生的H+被还原)。下表为pH和温度对本反应中NaBH4半衰期的影响(半衰期是指反应过程中,NaBH4的浓度降低到初始浓度一半时所需的时间)。
| 体系 pH |
不同温度下NaBH4的半衰期(min) |
|||
| 0℃ |
25℃ |
50℃ |
75℃ |
|
| 8 |
4. 32 ×100 |
6. 19 ×10-1 |
8. 64 ×10-2 |
1.22 ×10-2 |
| 10 |
4. 32 ×102 |
6. 19 ×101 |
8. 64 ×100 |
1.22 ×100 |
| 12 |
4. 32 ×104 |
6. 19 ×103 |
8. 64 ×102 |
1.22 ×102 |
| 14 |
4. 32 ×106 |
6. 19 ×105 |
8. 64 ×104 |
1.22 ×104 |
根据要求回答下列问题:
(1)NaBH4与水反应后所得溶液显碱性,则溶液中各离子浓度大小关系为___________。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响?
答: 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?
答: 。
(4)实验表明,将NaBH4溶于足量水,释放的H2比理论产量少得多(即反应一段时间后有NaBH4剩余也不再反应)。其可能原因是 。
化学反应原理在科研和生产中有广泛应用。
(1)一定条件下,模拟某矿石形成的反应aW+bQ→cN+dP+eR得到两个图像。
①该反应的△H 0(填“>”、“=”或“<”)。
②某温度下,平衡常数表达式为K =c2(X),则由图(2)判定X代表的物质为____。
(2)将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略
2G(g)。忽略
固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
则K(915℃)与K(810℃)的关系为K(915℃)____K(810℃)(填“大于”、“等于”或“小于”),a、b、f三者的大小关系为 ,1000℃、3.0 MPa时E的转化率为____。(3)25℃时,H2CO3 HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh= ,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O
HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh= ,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O  HCO3-+OH-的事实 。
HCO3-+OH-的事实 。
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图: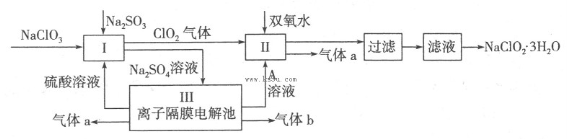
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
H2CO3 |
H2S |
| Ka/mol·L-1 |
1×10-2 |
6.3×10-4 |
K1=4.30×10-7 K2=5.60×10-11 |
K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。
D、A、B、C为四种原子序数依次增大的短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置 周期 族。
(2)A、B元素形成的常见化合物水溶液显 性,原因是(用离子方程式表示) 用石墨做电极电解该化合物的水溶液,则阴极反应式为 ,
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式 (用元素符号表示)。该反应中还原剂是 。
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:① B(s)+O2(g)=BO2(g);△H=-296.8kJ/mol②2BO2(g)+O2(g)  2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol
则1 mol BO3(g)若完全分解成B(s),反应过程中的热效应为 。
工业制备氯化铜时,将浓盐酸用蒸气加热到80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?______,理由是______________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是___________(填序号);
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?__________,理由是___________________________。
③现有下列几种常用的氧化剂,可用于除去该混合溶液中Fe2+的有_________(填序号)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2
除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有__________(填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3
25℃时,有关物质的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
H2SO3 |
| 电离平衡常数 |
K=1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
K1=1.5×10-2 K2=1.02×10-7 |
(1)三种酸由强至弱的顺序为 (用化学式表示)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为 。
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是 。
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是 。
A.c(CH3COO-)>c(HCO3-)>c(OH-)
B.c(Na+)+c(H+) = c(CH3COO-)+c(HCO3-)+c(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-)
D.c(CH3COO-)+c(CH3COOH) = c(HCO3-)+c(CO32-)
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性。则
①该溶液中c(H2A) c(A2-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾为FeSO4·7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为 。
②常温下若处理后的废水中c(Cr3+)=6.0×10-7 mol·L-1,则处理后的废水的pH=______。(Ksp[Cr(OH) 3]=6.0×10-31)
(1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
| 物质 |
H2(g) |
Br2(g) |
HBr(g) |
| 1 mol分子中化学键断裂时需要吸收的能量/kJ |
436 |
200 |
369 |
H2(g)+Br2(l)=2HBr(g) ΔH= 。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是 (填“图1”或“图2”);
②a= mL;
③c(Na+)=c(CH3COO-)的点是 点;
④E点对应溶液中离子浓度由大到小的顺序为 。
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量浓度分别为A和B,则A________B(填“>”、“=”或“<”)。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若向该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_________________________,其原因是_________________________。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是_______________。
②若为弱酸强碱盐,其第一步水解的离子方程式是___________________________。
工业上用重晶石(BaSO4)制备其他钡盐的常用方法主要有高温煅烧还原法、沉淀转化法等。
I.高温煅烧还原法
工业上利用重晶石高温煅烧还原法制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 =" +" 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =" +" 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2 =" +" 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2 =" +" 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为: 。
(2)反应C(s) + CO2(g) 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的可能是 。
II.沉淀转化法
(4)已知KSP(BaSO4) =1.0×10-10,KSP(BaCO3)=2.5×10-9。某同学设想用饱和Na2CO3溶液和盐酸将BaSO4转化成BaCl2,若用10 L Na2CO3溶液一次性溶解并完全转化1.0 mol BaSO4(溶液体积变化可忽略不计), 则该转化过程的离子方程式为 ; 反应的平衡常数K= ;Na2CO3溶液的最初浓度不得低于 。
LiAlH4由Li+、A1H4一构成,是有机合成中常用的还原剂。
(1)Al元素在周期表的位置是第__________周期__________族。
(2)比较离子半径大小:Li+__________ H一(选填“>"、“<”或“=”)。
(3)LiAlH4中含有的化学键类型为____________________________________。
(4)LiAlH4中氢元素的化合价为__________,它与水反应生成的单质气体为__________。
(5)LiCl溶液显酸性,用离子方程式说明原因____________________________________。
(6)如图所示,已知75%A的水溶液常用于医疗消毒,则A的结构简式为__________;CH3COOH与A在浓硫酸催化下生成B的有机反应类型为__________。