[江西]2012-2013学年江西省抚州市高二下学期期末考试化学试卷
生活中常用一些化学知识,下列分析或结论正确的是 ( )
| A.“地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物合理利用 |
| B.淀粉、油脂和蛋白质都是高分子化合物,能发生水解反应 |
| C.液化石油气的主要成分是甲烷 |
| D.酿酒过程中,淀粉水解后即得乙醇 |
下列化学用语正确的是 ( )
| A.1,2—二溴乙烷的结构简式:C2 H4 Br2 |
| B.羟基的化学式:OH- |
| C.己烷的分子式:C6H12 |
| D.乙烯分子的最简式:CH2 |
一定条件下,化学反应方向的判据为:△G=△H-T△S。已知反应A(s)= D(g)+E(g),△H-T△S=(-4499+11T)J/mol,(温度单位为K)。要防止A分解反应发生,温度必须( )
| A.高于或等于409K | B.低于136K |
| C.高于136K而且低于409K | D.任意温度 |
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,下列叙述正确的是( )
| A.2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ |
| B.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),吸收热量571.6 kJ |
| C.2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ |
| D.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
有机物X能实现下列转化:有机物X→葡萄糖→有机物Y→乙醛.下列判断错误的是( )
| A.X可以是淀粉或纤维素 | B.Y与CH3OCH3是同分异构体 |
| C.Y可以用于消除少量钠屑 | D.Y→乙醛属于消去反应 |
下列应用特征现象推断不正确的是( )
| A.遇FeCl3溶液显紫色或加入溴水产生白色沉淀,表示物质中可能含有酚羟基。 |
| B.加入新制Cu(OH)2悬浊液并加热,有红色沉淀生成,或加入银氨溶液并水浴加热有银镜出现,说明该物质中含有—CHO |
| C.加入金属钠,有H2产生,表示物质可能有—OH或—COOH |
| D.加入NaHCO3溶液有气体放出或能使紫色石蕊试液变红,表示物质中含有—COOH |
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧衍生物
| A.①③ | B.②④ | C.②③ | D.①④ |
对物质的空间结构的下列说法不正确的是 ( )
| A.具有4原子共线的可能含碳碳三键 |
| B.具有4原子共面一定含醛基 |
| C.具有6原子共面的可能含碳碳双键 |
| D.具有12原子共面的可能含苯环 |
如表为有关化合物的pKsp,pKsp=-lgKsp。某同学设计实验如下:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY;③向②中加入NaZ,沉淀又转化为AgZ。则表中a、b、c的大小关系为( )
| 相关化合物 |
AgX |
AgY |
AgZ |
| pKsp |
a |
b |
c |
A.a>b>c B.a<b<c C.c<a<b D.a+b=c
在室温下,等体积的下列酸和碱的溶液混合后,pH一定小于7的是( )
| A.pH=3的盐酸与pH=11的氨水 |
| B.pH=3的硝酸与pH=11的氢氧化钠溶液 |
| C.pH=3的硫酸与pH=11的氢氧化钾溶液 |
| D.pH=3的醋酸与pH=11的氢氧化钠溶液 |
化合物M叫假蜜环菌甲素(如图),它是香豆素类天然化合物。对M性质叙述正确的是( )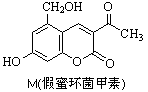
| A.M能与FeCl3发生反应,不能与CH3COOH发生反应 |
| B.M与Br2只能发生取代反应,不能发生加成反应 |
| C.1molM最多可消耗3mol NaOH |
| D.1molM在催化剂作用下最多能与4molH2发生加成反应 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液 ,pH=7,c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
有下列4种烷烃,它们的沸点由高到低的顺序是( )
①3,3二甲基戊烷 ②正庚烷 ③2甲基己烷 ④正丁烷
| A.②>③>①>④ | B.③>①>②>④ |
| C.②>③>④>① | D.②>①>③>④ |
除去下列物质中所含少量杂质(括号内),所选用的试剂和分离方法能达到实验目的的是
| |
混合物 |
试剂 |
分离方法 |
| A |
蔗糖(葡萄糖) |
银氨溶液 |
过滤 |
| B |
甲烷(乙烯) |
溴水 |
洗气 |
| C |
乙酸乙酯(乙酸) |
氢氧化钠溶液 |
蒸馏 |
| D |
淀粉胶体(氯化钠溶液) |
蒸馏水 |
分液 |
以下互为同系物的是
| A.硬脂酸甘油酯与三乙酸甘油酯 | B.油酸与软脂酸 |
| C.甘油与乙二醇 | D.丙烯酸与硬脂酸 |
丁腈橡胶具有许多优良性能,结构简式为合成丁腈橡胶的原料是( )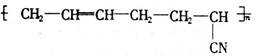
①CH2=CH—CH=CH2 ②CH3—C≡C—CH3 ③CH2=CH—CN
④CH3—CH ="CH" - CN ⑤CH3—CH=CH2 ⑥CH3—CH=CH—CH3
| A.③⑥ | B.②③ | C.①③ | D.④⑤ |
(1)有下列六组物质:属于同系物的是 ,属于同分异构体是 ,属于同种物质的是 。(填序号) 
(2)A.某烃与2倍的氢气加成后得到2,2-二甲基丁烷,按系统命名法,该烃的名称是 。
B.下图是某有机物结构简式, 按系统命名法,该有机物的命名正确的是 。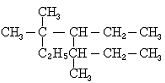
煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO (g) +H2O (g) H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
回答下列问题
(1)该反应的平衡常数表达式K= ,ΔH= 0(填“<”、“>”、“=”)
(2)已在一定温度下,C(s) +CO2 (g) 2CO (g)平衡常数K1;
2CO (g)平衡常数K1;
C (s) +H2O(g) CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 :
CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 :
(3)8000C时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时间后反应达到平衡,此时CO的转化率为 :若保持其他条件不变,向平衡体系中再通入0. 10molCO和0.40molCO2,此时v正 v逆 (填“>”、“=”或“<”)。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

(1) B装置有三种功能:①控制气流速度;②均匀混合气体;③
|
(2) 设V(Cl2)/V(CH4)=x,若理论上欲取代反应获得最多的氯化氢则x≥
(3) D装置的石棉中均匀混有KI粉末其作用是 。(4) 在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(5) E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。
A.分液法 B.蒸馏法 C.萃取分液法 D.结晶法
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)
A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| ⑴称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: ⑴A的相对分子质量为: 。 |
| ⑵将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g |
⑵A的分子式为: 。 |
| ⑶另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) |
⑶A中官能团的结构简式: 、 。 |
⑷A的核磁共振氢谱如下图: |
⑷A中含有 种氢原子 |
| ⑸综上所述,A的结构简式 。A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式 。 |
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成为是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: 
回答下列问题:
往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可以制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4的,可采用 方法。
| |
TiCl4 |
SiCl4 |
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |

 粤公网安备 44130202000953号
粤公网安备 44130202000953号